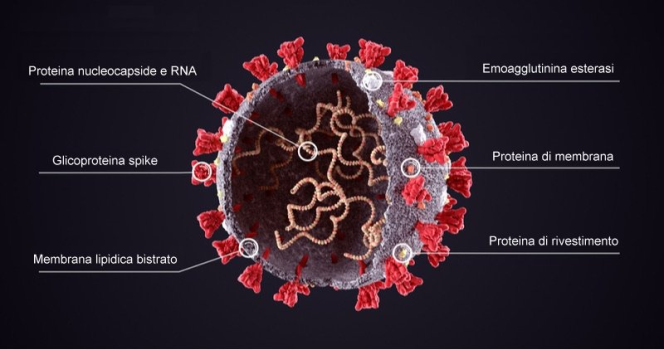
I vaccini anti-COVID: perché ci attende un futuro pieno di incognite
In primo pianoScienzeEssendo il comunicatore scientifico l’interfaccia, il trait d’union, fra gli scienziati e il mondo politico, la divulgazione scientifica ha fra i suoi compiti principali quello – assai elevato ma spesso disatteso – di informare la classica “casalinga di Voghera” e, soprattutto, il politico di turno di quel che davvero si pensa nel mondo internazionale della ricerca su temi di attualità, affinché i singoli individui, ma principalmente i decisori politici, possano adottare a ragion veduta misure e comportamenti quanto più consoni e lungimiranti possibile, non limitandosi ad “inseguire gli eventi” come è finora accaduto nella gestione italiana della pandemia di COVID-19. Perché stanno nascendo nuove e preoccupanti varianti del virus SARS-CoV-2? Quali sono i rischi conseguenti per una campagna multi-vaccinale ed, a cascata, per la nostra società sempre più stremata dal punto di vista economico e sociale? Quali sono gli scenari futuri che dobbiamo aspettarci nel caso migliore e in quello peggiore? Questo articolo cerca di rispondere in modo chiaro e documentato a tutte queste domande, o quanto meno di fornire al lettore gli elementi fattuali e gli strumenti culturali affinché possa arrivare da solo a una facile risposta.
Se non venissero usati vaccini per cercare di indurre un’immunità protettiva, la pandemia di COVID-19 – secondo i maggiori esperti mondiali – si attenuerebbe lentamente nel tempo fino a diventare una malattia endemica, come l’influenza. Quest’ultima famiglia di virus ha mostrato lo stesso andamento almeno quattro volte negli ultimi 100 anni, così come i coronavirus stagionali. Ma nonostante la maggior parte dei vaccini anti-COVID provochino una reazione immunitaria molto più forte dell’infezione naturale con il virus, senza i vaccini anti-COVID e senza un piano di prevenzione e cura domiciliare precoce vi sarebbero nel frattempo (cioè fino alla svilupparsi di un’immunità naturale nella popolazione) molti morti in poco tempo fra gli over 70 e/o si sarebbe costretti, in Paesi come l’Italia che non sono stati in grado di implementare alcuna misura alternativa, a frequenti lockdown per non saturare terapie intensive e ospedali.
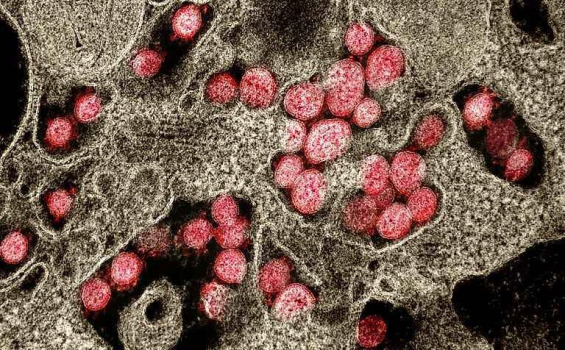
Immagine ottenuta mediante microscopio elettronico a trasmissione (MET) di particelle del virus SARS-CoV-2 (in rosso), isolate da un paziente affetto da COVID-19, mentre attaccano le cellule del tessuto polmonare circostante. (fonte: NIAID Integrated Research Facility in Fort Detrick, Maryland).
Ora, sebbene la pressione di selezione operi raramente durante una pandemia, poiché l’infezione di solito si risolve rapidamente (anche prima che la produzione di anticorpi sia completa), durante la fase endemica la situazione è diversa, poiché la presenza di anticorpi in individui già guariti e in persone che ricevono un’immunità passiva sotto forma di plasma convalescente, o anticorpi monoclonali terapeutici, esercita una pressione selettiva sul virus. Ciò determinerà quindi la selezione di varianti virali con la capacità di eludere questi anticorpi. Negli individui, nel tempo possono emergere diverse varianti dello stesso virus, dando origine a quasi-specie che possono soppiantare le versioni preesistenti [1].
I vaccini tentano di contrastare questo problema, ma possono introdurre anch’essi una pressione selettiva. L’impiego di vaccini, dunque, non è neutrale rispetto a un virus, ma in generale ne può influenzare l’evoluzione, come del resto possono farlo anche altri tipi di misure di sanità pubblica. Ciò può portare all’emergere di mutazioni nel genoma virale, per cui il ceppo endemico può eludere la risposta immunitaria provocata da ceppi precedenti dello stesso virus, complicando potenzialmente la vita sia ai ricercatori (che devono monitorare l’efficacia dei vaccini ed eventualmente adattarli alle nuove varianti) sia alle persone (cui potrebbero essere date nei prossimi mesi o anni “terze” dosi e forse anche “quarte” o “quinte”).
L’importanza della “teoria evolutiva della virulenza” nel controllo delle epidemie
L’opinione che la maggior parte dei medici e degli autori di testi di medicina aveva, fino a non molti anni fa, sull’evoluzione della “virulenza” – cioè, in pratica, del grado di aggressività per l’ospite umano – di un agente patogeno (virus, batterio o altro parassita), era che, quando la nostra specie e il parassita coevolvono per un lungo periodo di tempo, quest’ultimo tende a diventare meno virulento, evolvendo in definitiva verso una forma più benigna per l’uomo. Quest’idea era peraltro supportata da esempi famosi come quello del virus della mixomatosi, in cui un “nuovo” virus introdotto dall’uomo fra i conigli australiani si era evoluto, nel giro di pochi anni, in un germe assai meno virulento [2].
Sin dalla fine degli anni Settanta, tuttavia, alcuni biologi evoluzionisti, tra cui il prof. Paul W. Ewald dell’Università di Louisville (USA), hanno proposto un modo completamente nuovo di vedere le cose, che ha permesso di giungere a una vera e propria “teoria evolutiva della virulenza”, ben illustrata dallo stesso Ewald nel suo bel libro Evolution of Infectious Disease [3], che ebbi modo di studiare poco dopo la sua pubblicazione, quasi 25 anni fa. Secondo questi scienziati, la coevoluzione tra un agente patogeno e l’ospite umano – e, più in generale tra un parassita e una specie ospite – non evolve necessariamente verso una coesistenza benigna, bensì può rendere il germe più o meno virulento.

Il biologo evolutivo Paul Ewald e il suo libro in cui illustra la “teoria evolutiva della virulenza”.
Difatti, secondo la teoria evolutiva della virulenza, che ha reso ormai superata la vecchia teoria dei medici (basata sull’idea che i parassiti arrecanti poco o nessun danno ai loro ospiti hanno, come specie, la massima probabilità di sopravvivere sul lungo termine: essi prosperano – si pensava – perché anche gli organismi loro ospiti prosperano, per cui la selezione naturale deve favorirne una minore virulenza), in realtà la selezione naturale premia i parassiti che hanno la massima probabilità di sopravvivere sul lungo termine non come specie, bensì come singoli individui, secondo una visione darwiniana dell’evoluzione applicabile perfettamente non solo agli animali e alle piante ma anche ai microrganismi (e di cui il recente sviluppo della resistenza dei batteri agli antibiotici non è altro che l’ennesima conferma) [28].
Ma è proprio questo il punto, secondo gli evoluzionisti. Un patogeno resta innocuo o poco virulento finché le probabilità di contagio sono basse. Se però quel parassita “scopre” che passare da un individuo all’altro è diventato facile (come avvenne ad es. all’influenza “Spagnola” durante la Prima guerra mondiale, quando l’infezione poteva trasmettersi facilmente fra i soldati nelle trincee), allora può avere tutto l’interesse a riprodursi – e quindi a diffondersi – più rapidamente, anche a costo di uccidere il suo ospite. Viceversa, se nel caso di un patogeno altamente virulento il contagio di altre persone diventa per qualche ragione più difficoltoso, il germe avrà interesse a diventare meno virulento, per permettere all’ospite di restare attivo e assicurare al parassita la possibilità di entrare in contatto con altri potenziali ospiti.
Pertanto, la virulenza di un agente patogeno può diminuire o aumentare nel tempo, a seconda di quale opzione sia più vantaggiosa per i suoi geni, e ciò dipende dalla complessa influenza e interazione reciproca di vari: (1) fattori biologici, come la modalità e capacità di trasmissione del parassita, la sua capacità di sopravvivere per lunghi periodi di tempo al di fuori di un organismo ospite e la resistenza opposta dal sistema immunitario dell’ospite stesso; (2) fattori sociali, quali la densità di popolazione di una comunità umana, l’ambiente di vita e il comportamento delle persone (quest’ultimo, in particolare, determina la via e il momento della trasmissione del patogeno tra gli individui) [3].
Più della modalità di trasmissione e degli altri fattori biologici, comunque, è il comportamento dell’uomo a giocare, insieme agli altri fattori sociali, un ruolo fondamentale nell’evoluzione della virulenza di un agente patogeno che affligga la nostra specie. Certe scelte comportamentali delle singole persone nella vita di tutti i giorni, e quelle collettive in tema di sanità pubblica, oltre a preservare direttamente i singoli individui dal contrarre una determinata infezione, hanno un effetto meno immediato, ma fondamentale, nel ridurre il grado di virulenza del patogeno associato. In questo senso, il distanziamento sociale ed i lockdown con il COVID hanno avuto un’utilità accessoria: tenere sotto controllo la virulenza.
La letteratura medica offre ampie prove a favore di tali effetti, prodotti per lo più ostacolando la trasmissione degli agenti patogeni per via “culturale”: cioè, nel caso di molte malattie batteriche, informando sulla necessità di migliorare le condizioni igieniche (personali, delle fonti idriche, ospedaliere, eccetera); nel caso dell’AIDS, spingendo i soggetti delle categorie a rischio a usare siringhe non contaminate e ad adottare pratiche sessuali sicure (uso di preservativi, diminuzione della promiscuità e dei comportamenti ad alto rischio), e così via. Non è un caso, secondo Ewald, che del virus HIV si sia prodotta, in Africa, una variante molto più virulenta di quella che circola in Europa. [3]
L’applicazione sistematica alla medicina dell’approccio darwiniano alla virulenza costituisce, insomma, una nuova strada assai utile per contrastare i nuovi agenti patogeni, soprattutto virali, compresi quelli che attaccheranno in futuro l’uomo – per i quali non saranno disponibili subito vaccini – e per tenere sotto controllo quelli che già ci affliggono, sempre più difficilmente contrastabili dai trattamenti tradizionali con antibiotici o con altri farmaci. Infatti, esaminando i vari fattori biologici e sociali che influenzano la virulenza di un determinato patogeno, i biologi evoluzionisti possono prevedere i suoi decorsi evolutivi, scoprire ciò che più ci rende vulnerabili ad esso, e mettere a punto le terapie e i comportamenti sociali più adeguati per trasformare un pericoloso parassita in un germe meno temibile [2].
La “resistenza ai vaccini”: un pericolo legato a certi nuovi tipi di vaccini
La maggior parte delle persone ha sentito parlare di “resistenza agli antibiotici”, ma difficilmente di resistenza ai vaccini. Questo perché la resistenza agli antibiotici è un enorme problema globale che uccide ogni anno quasi 25.000 persone in Europa e egli Stati Uniti, e più del doppio in India. Invece, la maggior parte dei programmi di vaccinazione in tutto il mondo hanno avuto – e continuano ad avere – un enorme successo nel prevenire le infezioni e nel salvare vite umane. Addirittura, grazie ai vaccini il virus del vaiolo è stato del tutto eliminato dalla faccia della Terra, sebbene ciò abbia richiesto molto tempo.
Ma l’immunizzazione vaccinale sta anche rendendo più diffuse varianti genetiche di patogeni una volta rare o inesistenti, presumibilmente perché gli anticorpi sviluppati dai vaccinati non possono riconoscere e attaccare facilmente i ceppi mutanti che sembrano diversi dai ceppi vaccinali. Ed i vaccini in fase di sviluppo contro alcuni dei patogeni peggiori del mondo – ad esempio, malaria, antrace, etc. – si basano su strategie che potrebbero potenzialmente, secondo modelli evolutivi ed esperimenti di laboratorio, incoraggiare i patogeni a diventare ancora più pericolosi [4]; e, come vedremo, lo stesso potrebbe in linea teorica accadere con i vaccini anti-COVID, o almeno con alcuni di essi, dato che in realtà ne sono in corso di sviluppo nel mondo davvero moltissimi: circa 200.
I biologi evolutivi, in realtà, non sono sorpresi che ciò stia accadendo. Si tratta, infatti, di un ennesimo esempio della teoria evolutiva della virulenza al lavoro. Un vaccino rappresenta una nuova pressione selettiva esercitata su un agente patogeno e, se il vaccino non sradica completamente il suo bersaglio, i patogeni rimanenti maggiormente adattatisi – quelli in grado di sopravvivere, in qualche modo, in un mondo immunizzato – diventeranno più comuni. Questi agenti patogeni, insomma, si evolvono in risposta ai vaccini per il processo di selezione naturale applicata ai microrganismi.
La scienza dei vaccini è incredibilmente complicata, ma il meccanismo sottostante è in realtà molto semplice. Un vaccino espone il tuo corpo a dei patogeni vivi ma indeboliti o uccisi, o anche solo a determinati frammenti di essi (come nel caso della maggior parte dei vaccini anti-COVID, che utilizzano quale antigene, o bersaglio, la famosa proteina “spike”, una sorta di uncino che aggancia le cellule dell’ospite, in particolare – inizialmente – quelle delle vie respiratorie superiori). Questa esposizione incita il tuo sistema immunitario a creare degli eserciti di cellule immunitarie, alcune delle quali secernono proteine anticorpali per riconoscere e combattere i patogeni, se mai invadono di nuovo il corpo.
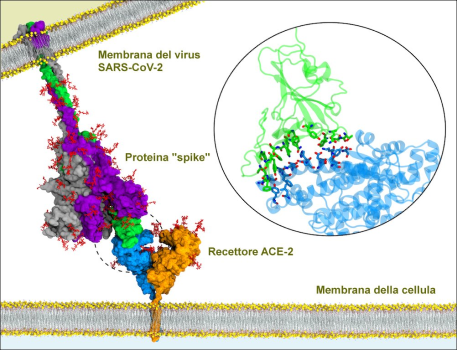
Questa immagine è un modello generato dal computer della proteina “spike” di una cellula SARS-CoV-2 (COVID-19), che si lega al recettore della proteina ACE-2 di una cellula umana. Attraverso questa connessione, le cellule virali sono in grado di trasferire il loro DNA e riprodursi.
Anche l’immunità indotta dai vaccini può variare, diminuendo nel tempo. Dopo aver ricevuto il vaccino per il tifo, ad esempio, i livelli di anticorpi protettivi di una persona diminuiscono nel corso di diversi anni, motivo per cui le agenzie di sanità pubblica consigliano richiami periodici per coloro che vivono o visitano regioni in cui il tifo è endemico. La ricerca suggerisce che un simile calo della protezione nel tempo si verifica anche con il vaccino contro la parotite. E ci aspettiamo che lo stesso accada con i vaccini anti-COVID, che quindi verosimilmente richiederanno dei richiami, con cadenze ancora non ben chiare.
I fallimenti dei vaccini causati dall’evoluzione indotta dal vaccino, invece, sono di natura diversa. Questi cali dell’efficacia del vaccino sono stimolati dai cambiamenti nelle popolazioni di patogeni che certi vaccini stessi causano direttamente. Gli scienziati hanno di recente iniziato a studiare in parte il fenomeno perché oggi possono farlo: i progressi nel sequenziamento genetico, infatti, hanno reso più facile vedere come i patogeni cambiano nel tempo. E molti di questi nuovi vaccini – come vedremo – hanno rafforzato la velocità con cui i patogeni mutano e si evolvono in risposta ai segnali ambientali.
Si può pensare alla vaccinazione come a una specie di setaccio, che impedisce a molti agenti patogeni di passare e sopravvivere. Ma se ne passano alcuni, quelli in quel campione non casuale che sopravviveranno preferenzialmente si replicheranno e, alla fine, cambieranno la composizione della popolazione patogena. I “quelli” citati potrebbero essere: (1) “ceppi mutanti di fuga” con differenze genetiche che consentono loro di sfuggire agli anticorpi innescati dal vaccino, o (2) semplicemente sierotipi che non sono stati presi di mira dal vaccino. In entrambi i casi, il vaccino altera il profilo genetico della popolazione patogena.
Alcuni esempi di evoluzione non desiderabile indotta da vaccini
I batteri che causano la pertosse illustrano molto bene come ciò possa accadere. Nel 1997, negli Stati Uniti le raccomandazioni [5] dei Centers for Disease Control and Prevention (CDC) iniziarono a promuovere l’adozione di un nuovo vaccino per prevenire l’infezione di questi batteri. Mentre il vecchio vaccino era realizzato utilizzando dei batteri interi uccisi, che stimolavano una risposta immunitaria efficace ma anche rari effetti collaterali, come convulsioni, la nuova versione – nota come vaccino “acellulare” – conteneva solo da due a cinque proteine della membrana esterna isolate dal patogeno.
Gli effetti collaterali indesiderati sono così scomparsi, ma sono stati sostituiti da nuovi problemi inaspettati. In primo luogo, per ragioni non chiare, nel corso del tempo la protezione conferita dal vaccino acellulare è diminuita. Di conseguenza, le epidemie hanno cominciato a scoppiare in tutto il mondo. Nel 2001, degli scienziati nei Paesi Bassi [6] hanno proposto un motivo aggiuntivo per l’indesiderata rinascita: forse la vaccinazione stava stimolando l’evoluzione, facendo sì che ceppi di batteri privi delle proteine-bersaglio, o che ne avevano versioni diverse, sopravvivessero in modo preferenziale.
Da allora gli studi hanno confermato questa idea. In un articolo del 2014 [7] pubblicato su Emerging Infectious Diseases, dei ricercatori australiani, guidati dal medico e microbiologo Ruiting Lan, presso l’Università del New South Wales hanno raccolto e sequenziato campioni del batterio della pertosse da 320 pazienti tra il 2008 e il 2012. La percentuale di batteri che non hanno espresso la pertactina, una proteina bersaglio del vaccino acellulare, è balzata dal 5% nel 2008 al 78% nel 2012, il che suggerisce che la pressione di selezione del vaccino stava consentendo ai ceppi privi di pertactina di diventare più comuni.
Anche il virus dell’epatite B, che causa danni al fegato, racconta una storia simile. L’attuale vaccino, che prende di mira principalmente una parte del virus noto come “antigene di superficie” dell’epatite B (l’antigene è una molecola in grado di essere riconosciuta dal sistema immunitario come estranea), è stato introdotto negli Stati Uniti nel 1989. Un anno dopo, in un articolo pubblicato su Lancet [8], i ricercatori hanno descritto strani risultati di una sperimentazione su un vaccino in Italia. Avevano rilevato virus dell’epatite B circolanti in 44 soggetti vaccinati, ma in alcuni di essi al virus mancava una parte di quell’antigene bersaglio. Si erano, dunque, sviluppati i già citati “ceppi mutanti di fuga”.
Negli Stati Uniti Andrew Read, professore di biologia alla Penn State University ed esperto di genetica evolutiva delle malattie infettive, sta studiando con i suoi collaboratori come l’herpesvirus che causa la cosiddetta “malattia di Marek” – un disturbo altamente contagioso, paralizzante e in definitiva mortale che costa all’industria dei polli più di 2 miliardi di dollari all’anno – potrebbe evolversi in risposta al suo vaccino. La malattia di Marek sta colpendo i polli in tutto il mondo da oltre un secolo; gli uccelli la prendono inalando polvere carica di particelle virali versate nelle penne di altri uccelli.
Questa malattia fornisce l’esempio meglio documentato dell’evoluzione della resistenza ai vaccini [9]. Il primo vaccino è stato introdotto nel 1970, quando la malattia stava uccidendo interi stormi. Funzionò bene, ma nel giro di un decennio iniziò misteriosamente a fallire; focolai di Marek hanno iniziato a scoppiare in stormi di polli vaccinati. Un secondo vaccino è stato autorizzato nel 1983 nella speranza di risolvere il problema, ma anch’esso ha gradualmente smesso di funzionare. Oggi, l’industria del pollame è al suo terzo vaccino. Funziona ancora, ma Read e altri temono che anch’esso un giorno possa fallire e non c’è un quarto vaccino in attesa. Peggio ancora, negli ultimi decenni il virus è diventato più letale.
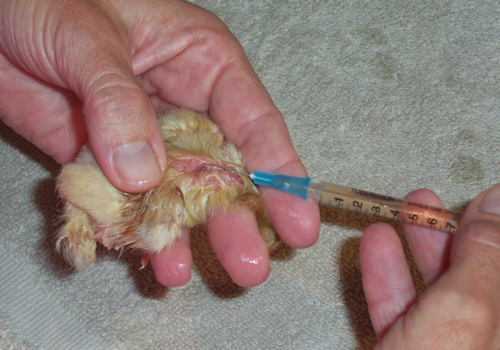
La malattia di Marek, una patologia che colpisce i polli, ci fornisce l’esempio meglio documentato del fenomeno della resistenza ai vaccini. Nella foto, un pulcino viene vaccinato contro di essa.
In un articolo del 2015 apparso su PLOS Biology [10], Read e colleghi hanno vaccinato 100 polli, lasciandone altri 100 non vaccinati. Hanno poi infettato tutti gli uccelli con ceppi di Marek che variavano per virulenza – cioè in quanto erano pericolosi e contagiosi. Il team ha scoperto che, nel corso della loro vita, gli uccelli non vaccinati immettono molto più ceppi meno virulenti nell’ambiente, mentre gli uccelli vaccinati immettono molto più ceppi più virulenti. I risultati suggeriscono quindi che il vaccino di Marek incoraggia la proliferazione di virus più pericolosi, che di conseguenza supererebbero le risposte immunitarie degli uccelli innescate dal vaccino e quelle degli stormi vaccinati ammalati.
I vaccini non sterilizzanti ed i potenziali rischi connessi
Proprio come gli agenti patogeni hanno modi diversi di infettarci e influenzarci, i vaccini che gli scienziati sviluppano impiegano strategie immunologiche diverse. La maggior parte dei vaccini che riceviamo durante l’infanzia (ad es. contro il morbillo) impediscono agli agenti patogeni di replicarsi dentro di noi e quindi ci impediscono anche di trasmettere le infezioni ad altri: sono, cioè, i cosiddetti vaccini “sterilizzanti”. E l’immunità sterilizzante è stata un fattore chiave per eliminare il vaiolo, eradicato ufficialmente nel 1980.
Ma finora gli scienziati non sono stati in grado di produrre questo tipo di vaccini sterilizzanti per patogeni complicati, come ad esempio la malaria e l’antrace. Per sconfiggere queste malattie, alcuni ricercatori hanno quindi sviluppato dei vaccini immunizzanti che prevengono le malattie senza effettivamente prevenire le infezioni: sono i cosiddetti vaccini “leaky”. E questi nuovi vaccini possono provocare un tipo di evoluzione microbica diversa e potenzialmente più spaventosa, di cui occorre tenere conto soprattutto nello scenario attuale dei molteplici vaccini anti-COVID già autorizzati o candidati (come detto, sono oltre 200 quelli in corso di sviluppo, e spesso molto diversi l’uno dall’altro per tecnologia usata).
La virulenza, come tratto di un patogeno, è direttamente correlata alla replicazione: più agenti patogeni ospita il corpo di una persona, e generalmente più malata diventa quella persona. Di conseguenza, la virulenza è definita come “la capacità di un agente patogeno di creare danni a un ospite”. Un alto tasso di replicazione fornisce però vantaggi evolutivi: più microbi nel corpo portano a più microbi nel moccio, nel sangue o nelle feci, il che offre ai microbi maggiori possibilità di infettare gli altri, ma ha anche dei costi, poiché può uccidere gli ospiti prima che abbiano la possibilità trasmettere la loro infezione.
Se un vaccino è completamente sterilizzante, il virus non può entrare nelle cellule, quindi non può evolvere perché non ha mai una possibilità di farlo. Ma se entra e si replica, c’è una pressione selettiva perché eviti gli anticorpi generati dal vaccino inefficiente. E in questa situazione non si sa mai quale sarà il risultato, che potrebbe trasmettersi in seguito ad altri contagiati. Il problema con i vaccini leaky è che consentono agli agenti patogeni di replicarsi senza controllo proteggendo allo stesso tempo gli ospiti da malattie e morte, eliminando così i costi associati all’aumento della virulenza.
Nel tempo, quindi, in un mondo di vaccinazioni fatte con vaccini leaky – come è quello in cui siamo entrati per prevenire il COVID-19 – l’agente patogeno potrebbe evolversi fino a diventare più mortale per gli ospiti non vaccinati, perché può raccogliere i benefici della virulenza senza, appunto, i costi, proprio come la malattia di Marek è diventata lentamente più letale per i polli non vaccinati [4]. E questa maggiore virulenza può anche far sì che il vaccino inizi a fallire, causando malattie negli ospiti vaccinati. Si tratta di due rischi molto importanti che dobbiamo potenzialmente aspettarci anche con i vaccini anti-COVID.
In un articolo del 2012 pubblicato su PLOS Biology [11], Andrew Read e Victoria Barclay hanno inoculato nei topi un vaccino anti-malaria leaky, usando questi topi infetti ma non malati per infettare altri topi vaccinati. Dopo che i parassiti sono circolati attraverso 21 cicli di topi vaccinati, Barclay e Read li hanno studiati e confrontati con quelli circolati attraverso 21 cicli di topi non vaccinati. Hanno così scoperto che i ceppi dei topi vaccinati erano diventati molto più virulenti, in quanto si erano replicati più velocemente e avevano ucciso più globuli rossi, rimanendo gli unici parassiti mortali alla fine dei 21 cicli di infezione.
Nel marzo 2017, Read e il suo collega David Kennedy della Penn State University hanno pubblicato, negli Atti della Royal Society B [9], un importante articolo scientifico in cui hanno delineato diverse strategie che gli sviluppatori di vaccini potrebbero utilizzare per garantire che i vaccini futuri non vengano puniti dalle forze evolutive. Una raccomandazione generale è che i vaccini dovrebbero indurre risposte immunitarie contro più bersagli. In una situazione del genere, diventa infatti molto più difficile per un agente patogeno accumulare tutti i cambiamenti necessari per sopravvivere.
Aiuta anche se i vaccini prendono di mira tutte le varianti o sottopopolazioni conosciute di un particolare patogeno, non solo quelle più comuni o pericolose. I vaccini dovrebbero pure impedire agli agenti patogeni di replicarsi e trasmettersi all’interno degli ospiti inoculati. Uno dei motivi per cui con i vaccini sterilizzanti la resistenza ai vaccini è meno problematica della resistenza agli antibiotici, è che essi vengono somministrati prima dell’infezione e limitano la replicazione, il che riduce al minimo le opportunità evolutive. Mentre questo non è vero, evidentemente, per i vaccini leaky. E se virus e batteri cambiano rapidamente in parte è proprio perché si replicano come matti all’interno dell’ospite.
Il materiale genetico di tutti i virus, infatti, è codificato in DNA o RNA; una caratteristica interessante dei virus a RNA è che cambiano molto più rapidamente dei virus a DNA. Ogni volta che fanno una copia dei loro geni commettono uno o pochi errori. Quando un virus a RNA si replica, il processo di copia genera un nuovo errore, o mutazione, per 10.000 nucleotidi, un tasso di mutazione fino a 100.000 volte maggiore di quello riscontrato nel DNA umano. Proprio come le persone – ad eccezione dei gemelli identici – hanno tutte genomi distintivi, le popolazioni di un virus tendono ad essere composte da una miriade di varianti genetiche, alcune delle quali se la cavano meglio di altre durante le battaglie con anticorpi addestrati al vaccino. I vincitori seminano la popolazione patogena del futuro.
I vaccini contro il SARS-CoV-2 sono sterilizzanti o vaccini “leaky”?
Il virus SARS-CoV-2 che produce il COVID-19 è un betacoronavirus, appartenente alla famiglia dei coronavirus (CoV), che comprende sia il virus della SARS che quello della MERS. Questi sono virus a RNA con genomi molto grandi, di circa 30 kb di lunghezza. La famiglia prende il nome dalla caratteristica “corona” di proteine, o spike, che sporge dalla superficie del virus. L’accumulo di molteplici cambiamenti nella proteina spike ha portato, negli scorsi mesi, alla nascita di alcune varianti del SARS-CoV-2, come la variante inglese (nota come B.1.1.7), la variante sudafricana (nota come B.1.351) e la variante brasiliana (nota come B.11.28).
I primi vaccini contro l’attuale coronavirus (SARS-CoV-2) ad essere autorizzati si sono dimostrati variamente efficaci nel ridurre la malattia da COVID-19 nel ceppo originale, il Wuhan-Hu-1. Nonostante ciò, non sappiamo ancora se questi vaccini – e tantomeno, eventualmente, quali e in che misura – possano indurre l’immunità sterilizzante. Si prevede che i dati che affrontano queste fondamentali domande saranno presto disponibili dagli studi clinici sui vaccini in corso. Intanto sappiamo che la variante sudafricana (B.1.351) può sfuggire agli anticorpi nel sangue di persone precedentemente infette [27], il che evidenzia la prospettiva di una reinfezione con varianti antigenicamente distinte e può prefigurare una ridotta efficacia degli attuali vaccini basati sulla proteina spike. Ma anche se l’immunità sterilizzante – che, ripeto, con questi primi vaccini è tutta da dimostrare! – venisse indotta inizialmente, essa potrebbe comunque cambiare nel tempo con il diminuire delle risposte immunitarie e con l’evoluzione virale.
Per l’immunità sterilizzante occorre un particolare tipo di anticorpo noto come “anticorpo neutralizzante”. Questi anticorpi bloccano l’ingresso del virus nelle cellule e ne impediscono la replicazione. Il virus infettante dovrebbe essere identico al virus del vaccino per indurre l’anticorpo perfetto. Non a caso, molti vaccini virali tradizionali presentano l’intero virus in un forma viva attenuata (morbillo, parotite, rosolia, varicella, rotavirus, poliovirus orale Sabin, febbre gialla e alcuni vaccini antinfluenzali) o in una forma inattivata (polio virus Salk, epatite A, rabbia e altri vaccini antinfluenzali), portando a una risposta multipla, diretta non solo verso un’unica proteine virale, ma verso numerose proteine virali contemporaneamente.
Questa molteplicità di risposte anticorpali, probabilmente, spiega perché per questi vaccini non sono stati documentati “ceppi di fuga” del virus dal vaccino. L’eccezione è rappresentata dal virus dell’influenza, in cui la cosiddetta “deriva virale antigenica” (ovvero le mutazioni che si accumulano nel tempo nelle due proteine bersaglio) e lo spostamento o riassortimento antigenico (ricombinazione dei segmenti proteici che porta a una diversa combinazione nelle due proteine) significano che la risposta immunitaria a precedenti ceppi influenzali (o vaccini) non è più efficace nel prevenire l’infezione dai nuovi ceppi.
Tuttavia, la lunghezza della proteina spike usata dai vaccini autorizzati contro il SARS-CoV-2 è relativamente breve (circa 1270 aminoacidi) e un articolo in forma di preprint [12] ha indicato che la risposta anticorpale naturale alle infezioni (e presumibilmente anche a un vaccino basato sulla proteina spike) è concentrata in sole due sezioni della proteina. Dato che la risposta anticorpale alla proteina spike è così concentrata, occorre domandarsi, come hanno fatto T. Williams & W. Burgers su Lancet [13]: “potrebbero delle semplici mutazioni in queste sequenze limitate portare a un vaccino meno efficace, se la risposta immunitaria umana è così specifica a causa della sequenza ridotta usata dal vaccino?”.
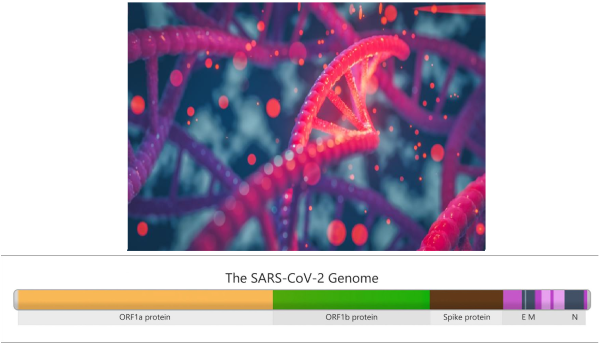
I geni nel genoma di SARS-CoV-2 che contengono istruzioni per costruire parti del virus sono mostrati in colori diversi. Ad esempio, la sezione marrone nell’immagine contiene istruzioni genetiche per costruire la proteina “Spike”, che consente al virus di attaccarsi alle cellule umane durante l’infezione. Questa sezione del genoma funge da regione chiave per il monitoraggio delle mutazioni.
Ora, è vero che il SARS-CoV-2 non è un virus “segmentato” come quelli dell’influenza e che il suo tasso di mutazione risulta essere inferiore a quello di altri virus a RNA. Tuttavia, i risultati di un preprint del 2020 [14], esaminando il plasma convalescente per altri coronavirus umani – come il coronavirus umano 229E – suggeriscono che, come per l’influenza, le naturali mutazioni nell’uomo del coronavirus 229E con il tempo potrebbero rendere gli individui meno in grado di neutralizzare i nuovi ceppi. Dunque, qualcosa del genere potrebbe succedere anche per il SARS-CoV-2, e portare alla fine a un vaccino meno efficace.
Oggi è in uso un numero minore di vaccini virali ricombinanti, più simili nell’approccio a quelli recentemente concessi in licenza per il SARS-CoV-2. Essi sono fatti tramite l’ingegneria genetica: il gene che crea la proteina per il virus viene isolato e posizionato all’interno dei geni di un’altra cellula; quando quella cellula si riproduce, produce proteine vaccinali, il che significa che il sistema immunitario riconoscerà la proteina e proteggerà il corpo da essa. Uno di questi vaccini è quello per il virus dell’epatite B, che usa una delle proteine dell’involucro virale, la superficie dell’antigene HBV. Gli anticorpi neutralizzanti sono mirati principalmente a una sequenza di 25 amminoacidi, dal 124 al 149. Ebbene, mutazioni puntiformi che provocano un’arginina rispetto al residuo di glicina nella posizione 145 in questa sequenza portano a un fallimento degli anticorpi neutralizzanti indotti dal vaccino e ad infezioni negli individui vaccinati [15].
I vaccini contro l’influenza, in genere, inducono protezione dalle malattie, ma non necessariamente protezione dalle infezioni. Ciò è in gran parte dovuto ai diversi ceppi di influenza che circolano, una situazione che può verificarsi anche con il SARS-CoV-2. Un fattore protettivo è il tasso di mutazione relativamente basso del SARS-CoV-2, ma l’infezione prolungata negli ospiti immunocompromessi potrebbe accelerare la mutazione, tant’è che nei pazienti affetti da HIV la resistenza agli antivirali si sviluppa rapidamente [9] (per tale ragione i pazienti con HIV non sono stati inclusi nei trial sui vaccini anti-COVID). Ed il fatto che esistano così tanti diversi vaccini anti-COVID in uso o in sperimentazione sulla popolazione facilita, con la pressione selettiva esercitata, il crearsi di “ceppi di fuga”.
Gli esperimenti con gli anticorpi monoclonali e lo sviluppo di una resistenza
Nei vaccini anti-COVID, queste mutazioni indesiderate potrebbero essere guidate da (1) deriva antigenica, o (2) per selezione, durante l’infezione naturale oppure a causa del vaccino stesso. Quando un virus viene coltivato sotto la pressione selettiva di un singolo anticorpo monoclonale che prende di mira un singolo epitopo (la piccola parte dell’antigene che lega l’anticorpo specifico) su una proteina virale, le mutazioni in quella sequenza proteica porteranno alla perdita di neutralizzazione, e alla generazione di “ceppi di fuga”. Questa sequenza di eventi è stata mostrata in laboratorio per la polio, il morbillo e il virus respiratorio sinciziale [16], e nel 2020 anche per il SARS-CoV-2 [17].
Un’altra scoperta importante è che il SARS-CoV-2, anche in presenza di anticorpi policlonali (nella forma dei sieri di convalescenti), può mutare e sfuggire alla neutralizzazione da parte degli anticorpi multipli del plasma di altre persone. Infatti, in una serie di esperimenti in vitro descritti in un preprint del 2020, il SARS-CoV-2 è stato coltivato in presenza di plasma neutralizzante di un convalescente [18]. Dopo alcuni passaggi seriali, erano state generate tre mutazioni nelle due sezioni-bersaglio della proteina spike che hanno permesso la formazione di una nuova variante del tutto resistente alla neutralizzazione del plasma. Quando questo virus è cresciuto in presenza di plasma convalescente di altri 20 pazienti, tutti i campioni hanno mostrato una riduzione dell’attività di neutralizzazione.
La sostituzione di amminoacidi osservata in questo esperimento si trova – guarda caso – nella stessa posizione delle mutazioni riportate in un preprint che descrive esperimenti di selezione di anticorpi monoclonali (con le varianti mutanti che sfuggono alla neutralizzazione di sieri umani convalescenti) [19] e di quella trovata nella famosa “variante sudafricana” del SARS-CoV-2 che si sta diffondendo rapidamente in Sud Africa e che ha mostrato di essere meno suscettibile alla neutralizzazione da parte di plasma convalescente di individui esposti alle precedenti varianti del coronavirus. E, sempre guarda caso, le varianti inglese, sudafricana e brasiliana sono emerse in Paesi dove erano in corso trial di vaccini anti-COVID.
In linea di principio, questi risultati suggeriscono che le varianti di SARS-CoV-2 potrebbe evolversi, in alcune persone, sviluppando una resistenza all’immunità indotta da vaccini ricombinanti diretti alla proteina spike (che sono basati sulla sequenza originale, la Wuhan-Hu-1). Ma solo gli studi clinici in corso mostreranno se gli individui vaccinati riconoscono le varianti SARS-CoV-2 in modo diverso, e se le mutazioni riducono la protezione del vaccino in alcuni individui vaccinati. La sperimentazione di fase 3 in corso di un vaccino a base di spike con vettore di adenovirus (Johnson & Johnson) in Sud Africa, dove la variante sudafricana sta sostituendo le varianti preesistenti, può fornire un’opportunità per esaminare questa domanda.
A causa dell’efficiente apparato di correzione di bozze del SARS-CoV-2, il tasso di sostituzione dei nucleotidi è più lento rispetto ad altri virus a RNA. Ciò ha portato alla speranza che l’antigene spike sarebbe rimasto stabile e che tutti i ceppi attualmente in circolazione sarebbero stati quindi suscettibili agli anticorpi neutralizzanti sviluppati in risposta ai primi vaccini. Uno studio di McCarthy et al. [20] riporta, tuttavia, che il coronavirus si sta adattando alla presenza di immunità – come segnalato da mutazioni di delezione ripetute in siti specifici della proteina spike – causando la rapida evoluzione della diversità antigenica, e soprattutto questa “mutazione di fuga” viene trasmessa anche ad altri individui. La spiegazione più ovvia è che questa delezione sia sorta in risposta a una forte e comune pressione selettiva.
In definitiva, la maggior parte dei vaccini anti-COVID addestrano il sistema immunitario a rilevare gli antigeni sulla superficie del SARS-CoV-2 e l’antigene più usato è la proteina spike, che viene vista come il bersaglio vaccinale più efficace. Quindi, ora che sta emergendo la prova che quelle particolari varianti sembrano influenzare l’efficacia del vaccino, dovrebbe essere necessario riformulare periodicamente i vaccini così che si adattino meglio ai ceppi circolanti. Per questa ragione, Moderna (e probabilmente anche altri produttori) stanno considerando due strategie “booster”, cioè di potenziamento dell’immunità nei vaccinati: (1) una terza dose dello stesso vaccino odierno; (2) in alternativa, una terza dose con un mRNA in cui sono state opportunamente incorporate le mutazioni della nuova variante sudafricana [21].
Le mutazioni nella proteina spike sono alla base delle principali varianti che destano preoccupazione. Dunque, i vaccini anti-COVID che prendono di mira questa proteina sul breve termine risolvono un problema ma dall’altro possono crearne di nuovi, soprattutto nel tempo e guardando quindi al futuro. Inoltre, anche i vaccini che usano due dosi potrebbero favorire la creazione di “ceppi mutanti di fuga”, dato che dopo la prima dose l’immunizzazione è solo parziale. Anche la lenta introduzione delle vaccinazioni in alcuni Paesi può dare il tempo al virus di mutare la sua proteina spike e sfuggire al vaccino (donde l’importanza di una politica globale di vaccinazione e della fornitura di vaccini ai Paesi che non possono permettersi di pagarli). Con il passare del tempo, alcuni vaccini potrebbero persino iniziare ad esacerbare le infezioni da COVID-19 attraverso un fenomeno noto come “potenziamento dipendente dall’anticorpo”, dove alcuni anticorpi si attaccano al virus in modo errato e finiscono per contribuire all’infezione [26].
Conclusione: verso un futuro davvero pieno di incognite
Sebbene l’immunità sterilizzante sia spesso l’obiettivo finale della progettazione del vaccino, raramente viene raggiunto. Fortunatamente, ciò non ha impedito in passato a molti vaccini diversi di ridurre sostanzialmente il numero di casi di infezioni da virus. Riducendo i livelli di malattia negli individui, si riduce anche la diffusione del virus attraverso le popolazioni. Pertanto, essa potrebbe essere stata un obiettivo troppo elevato per i produttori di vaccini COVID-19, ma secondo molti esperti potrebbe non essere necessaria per frenare la malattia e portare l’attuale pandemia sotto controllo [22].
Il caso del rotavirus, che causa vomito grave e diarrea acquosa ed è particolarmente pericoloso per neonati e bambini piccoli, è abbastanza semplice in questo senso. La vaccinazione limita, ma non ferma, la replicazione dell’agente patogeno. In quanto tale, non protegge da malattie lievi. Riducendo la carica virale di una persona infetta, tuttavia, diminuisce la trasmissione, fornendo una protezione indiretta sostanziale. Secondo i Centers for Disease Control (CDC) statunitensi, 10 anni dopo l’introduzione nel 2006 di un vaccino contro il rotavirus negli USA, il numero di positivi ai test per la malattia è sceso del 90% [22]. Quindi, anche con i vaccini anti-COVID si potrebbero avere nuovi infetti asintomatici o paucisintomatici.
Tuttavia gli imprevisti sono dietro l’angolo, come abbiamo visto essere successo con vaccini non sterilizzanti che prendevano di mira una sola o poche proteine virali. E quando, l’anno scorso, più di 1.000 scienziati del vaccino si sono riuniti a Washington D.C. (USA), al World Vaccine Congress, la questione dell’evoluzione indotta dal vaccino – incredibilmente – non è stata al centro di nessuna sessione scientifica. I ricercatori sono nervosi nel parlare e richiamare l’attenzione sui potenziali effetti evolutivi perché temono che, così facendo, potrebbero alimentare più paura e sfiducia nei confronti dei vaccini da parte del pubblico, anche se l’obiettivo è, ovviamente, garantire il successo del vaccino a lungo termine.
Al contrario, alcuni degli esperti di virus a cui non sfuggono i potenziali effetti evolutivi si sono espressi preoccupati del fatto che l’aggiunta di una “pressione evolutiva” all’agente patogeno mediante l’applicazione di quello che potrebbe non essere un vaccino completamente protettivo – come uno dei tanti vaccini sperimentali anti-COVID – possa alla fine peggiorare le cose. “Una protezione meno che completa potrebbe fornire una pressione selettiva che spinga il virus a eludere l’anticorpo presente, creando ceppi che poi eludono tutte le risposte ai vaccini”, secondo Ian Jones, professore di virologia presso la Reading University (UK). “In questo senso, un cattivo vaccino è peggio di nessun vaccino!” [23, 4]. Tuttavia, va sottolineato che al momento si tratta di un “peggior scenario” teorico, e che comunque – sia ben chiaro – non mette in discussione l’importanza della vaccinazione di massa.
Se quello appena illustrato è uno degli scenari peggiori, lo scenario migliore non lo è poi tanto di più, visto che, come ritiene Alexandre Le Vert, CEO e co-fondatore della casa di vaccini francese Osivax, “dovremmo aspettarci che più varianti appaiano periodicamente e molto probabilmente raggiungeremo una situazione simile all’influenza, dove più varianti circoleranno ogni stagione invernale” [26]. Dunque, si prospettano vaccinazioni a go-go per la popolazione e un business multi-miliardario per le case farmaceutiche. Un modo per aggirare la “corsa agli armamenti” del vaccino è lo sviluppo di un vaccino universale che sia a prova di futuro contro il coronavirus in evoluzione. Per capire come un tale vaccino potrebbe funzionare, un indizio chiave sta nell’esaminare – come abbiamo fatto in precedenza – i vaccini per altre infezioni virali che sono rimasti efficaci per decenni: stiamo parlando dei già citati vaccini sterilizzanti.
Poche aziende stanno sviluppando vaccini vivi attenuati per il COVID-19, anche se questi possono fornire una protezione molto forte: sono difficili da trasportare e potrebbero non essere sicuri per le persone con sistemi immunitari indeboliti. La maggior parte degli sviluppatori ha quindi optato per altri approcci, come vaccini inattivati (Sinovac, Novovax, etc.), vettori virali (Astrazeneca, Johnson & Johnson, Sputnik, etc.) e vaccini a mRNA (Pfizer, Moderna, CureVac, etc.). Nel caso del SARS-CoV-2, non ci sono ancora dati di efficacia dei vaccini inattivati in fase 3, ed i dati parziali apparsi sulla stampa mostrano al momento risultati controversi. Bisogna inoltre tener presente che la produzione dei vaccini inattivati richiede bioreattori per la crescita di virus vivo in alte condizioni di contenimento. Al contrario, i vaccini a mRNA e quelli a vettore virale sono fra i più semplici e veloci da realizzare.
Se i vaccini vivi attenuati sono fuori dal tavolo, come possono altri tipi di vaccini ottenere una protezione duratura? Emergex è uno dei numerosi sviluppatori di vaccini che si concentrano sui cosiddetti “linfociti T” – una parte fondamentale della nostra “memoria” immunitaria per infezioni future – e sugli antigeni interni del SARS-CoV-2. Come ha spiegato il suo CEO, Thomas Rademacher: “I nostri risultati suggeriscono che prendere di mira le proteine di superficie, e in particolare la proteina spike, potrebbe non produrre una risposta immunitaria altrettanto sicura, efficace e di lunga durata rispetto a quella osservata con i vaccini vivi attenuati” [26]. Osivax sta usando un approccio simile, sviluppando un vaccino che consiste in nanoparticelle che trasportano copie di antigeni COVID-19 interni. Va detto, comunque, che anche per gli altri tipi di vaccini si è riscontrata la capacità di indurre la citata “risposta T”, come illustrato ad esempio, per il vaccino Pfizer, dal lavoro di Prendecki et al. [29].
Credo che al lettore risulterà a questo punto chiaro come la corsa ai vaccini sia in realtà soltanto all’inizio, mentre le nostre economie e il tessuto sociale sono sempre più provati. Pertanto, negli altri Paesi molti esperti si chiedono se saremo in grado di stare dietro – come progettazione e produzione dei vaccini, nonché accettazione degli stessi da parte della popolazione – alle ulteriori future varianti di SARS-CoV-2 che molto verosimilmente sorgeranno, indotte in molti casi dai vaccini medesimi [24]. In Italia questo dibattito non è mai partito, nonostante la conoscenza di questi temi e dei relativi risvolti dovrebbe essere portata anche all’attenzione della politica già in questa fase, non certo “a babbo morto”, al fine di prendere le decisioni migliori e di effettuare la pianificazione conseguente, uscendo dalla logica dell’inseguire gli eventi che ha guidato finora la gestione della pandemia nel nostro Paese.
In Italia, invece, i medici che in televisione informano il grande pubblico si limitano a ripetere il mantra “che un calo della velocità di trasmissione significa meno infezioni; una minore replicazione del virus porta a minori opportunità di evoluzione del virus negli esseri umani; e con meno possibilità di mutare, l’evoluzione del virus rallenta e c’è un minor rischio di nuove varianti”. Ma, come purtroppo abbiamo visto in dettaglio, se i vaccini anti-COVID utilizzati nei trial o approvati sono “leaky” – o se anche solo alcuni di essi lo sono – pure una vaccinazione di massa degli italiani / europei lascerebbe al virus ampie opportunità di creare nuovi “ceppi di fuga” (da noi o nei Paesi poveri) e, qualora questi ultimi eludessero i vaccini da noi usati, ciò rischierebbe di farci tornare, da un momento all’altro, quasi alla casella di partenza.
Proprio per tutte queste ragioni è – a mio modesto parere – importante, per la politica sanitaria anti-COVID, non solo riflettere con molta più obiettività e lungimiranza su tutta la faccenda, ma soprattutto implementare contemporaneamente un “piano B” che sia del tutto svincolato dai vaccini e mirato a risolvere il problema (saturazione delle terapie intensive e dei reparti di cure a bassa intensità degli ospedali) alla radice, ovvero facendo in modo che meno persone ricorrano all’ospedale, grazie: (1) alla prevenzione tramite opportune campagne di informazione che invitino almeno la popolazione più a rischio a compensare i bassi livelli di vitamina D (questione chiave già illustrata in un mio articolo [25]), e comunque non per ridurre il rischio di infezione bensì la gravità della stessa; e (2) alla cura ai primi sintomi attraverso un serio ed efficace protocollo di cura domiciliare, oggi di fatto assente.
Desidero ringraziare, per la lettura critica del manoscritto e gli utili suggerimenti forniti, il dr. Piergiuseppe De Berardinis (direttore del Laboratorio di immunologia presso l’Istituto di Biochimica e Biologia Cellulare del CNR), che in questi anni si è occupato di studiare la risposta immunitaria e la problematica dei vaccini sia dal punto di vista sperimentale che divulgativo. Naturalmente, la responsabilità di eventuali inesattezze o errori residui è solo ed esclusivamente dell’Autore.
Riferimenti bibliografici
[1] Thomas L., “SARS-CoV-2 spike deletion mutations may evade current vaccine candidates, study finds”, News Medical Life Sciences, 23 novembre 2020.
[2] Menichella M., “Mondi futuri. Viaggio fra i possibili scenari”, SciBooks Edizioni, Pisa, 2005.
[3] Ewald P.W., “Evolution of Infectious Disease”, Oxford University Press, New York, 1994.
[4] Boots M., “The Need for Evolutionarily Rational Disease Interventions: Vaccination Can Select for Higher Virulence”, PLoS Biology, 2015.
[5] No author listed, “Pertussis vaccination: use of acellular pertussis vaccines among infants and young children. Recommendations of the Advisory Committee on Immunization Practices (ACIP)”, CDC Recommendations and Reports, 1997.
[6] Van Gent M., “Studies on Prn Variation in the Mouse Model and Comparison with Epidemiological Data”, PLoS ONE, 2011.
[7] Lam C., Lan R. et al., “Rapid increase in pertactin-deficient Bordetella pertussis isolates, Australia”, Emerging Infectious Diseases, 2014.
[8] Carman W.F. et al., “Vaccine-induced escape mutant of hepatitis B virus”, The Lancet, 1990.
[9] Kennedy D.A., Read A.F., “Why does drug resistance readily evolve but vaccine resistance does not?”, Royal Society Acta B, 2017.
[10] Read A.F., “Imperfect Vaccination Can Enhance the Transmission of Highly Virulent Pathogens”, PLoS Biology, 2015.
[11] Barclay V.C. et al., “The Evolutionary Consequences of Blood-Stage Vaccination on the Rodent Malaria Plasmodium chabaudi”, PLoS Biology, 2012.
[12] Greaney A.J., “Comprehensive mapping of mutations to the SARS-CoV-2 receptor-binding domain that affect recognition by polyclonal human serum antibodies”, preprint, BioRxiv, 2021.
[13] Williams T.C., Burgers W.A., “SARS-CoV-2 evolution and vaccines: cause for concern?”, Lancet Respir. Med., 29 gennaio 2021.
[14] Eguia R.D. et al., “A human coronavirus evolves antigenically to escape antibody immunity”, preprint, BioRxiv, 18 dicembre 2020.
[15] Romanò L. et al., “Hepatitis B vaccination”, Human Vaccines & Immunotherapeutics, 2015.
[16] Mas V. et al., “Antigenic and sequence variability of the human respiratory syncytial virus F glycoprotein compared to related viruses in a comprehensive dataset”, Vaccine, 2018.
[17] Weisblum Y., “Escape from neutralizing antibodies by SARS-CoV-2 spike protein variants”, eLife, 2020.
[18] Andreano E. et al., “SARS-CoV-2 escape in vitro from a highly neutralizing COVID-19 convalescent plasma”, preprint, bioRxiv, 2020.
[19] Liu Z. et al., “Landscape analysis of escape variants identifies SARS-CoV-2 spike mutations that attenuate monoclonal and serum antibody neutralization”, bioRxiv, 2021.
[20] McCarthy K.R. et al., “Recurrent deletions in the SARS-CoV-2 spike glycoprotein drive antibody escape”, preprint, BioRxiv, 19 gennaio 2021.
[21] Kupferschmidt K., “Vaccine 2.0: Moderna and other companies plan tweaks that would protect against new coronavirus mutations”, Science, 26 gennaio 2021.
[22] McKenna S., “Vaccines Need Not Completely Stop COVID Transmission to Curb the Pandemic”, Scientific American, 18 gennaio 2021.
[23] Kelland K., “Russia vaccine roll-out plan prompts virus mutation worries”, Reuters, 21 agosto 2020.
[24] Kuhn R., “Coronavirus variants, viral mutation and COVID-19 vaccines: The science you need to understand”, The Conversation, 2 febbraio 2021.
[25] Menichella M., “Vitamina D e minore mortalità per COVID-19: le evidenze e il suo uso per prevenzione e cura, Fondazione David Hume, 23 febbraio 2021.
[26] Smith J., “Can Covid-19 Vaccines Keep up with an Evolving Virus?”, Labiotech, 11 febbraio 2021.
[27] Wang P. et al., “Increased Resistance of SARS-CoV-2 Variants B.1.351 and B.1.1.7 to Antibody Neutralization”, preprint, bioRxiv, 26 gennaio 2021.
[28] Ewald, P.W., “Evolution of virulence”, Infectious Disease Clinics of North America, 2004.
[29] Prendecki et al., “Effect of previous SARS-CoV-2 infection on humoral and T-cell responses to single-dose BNT162b2 vaccine”, The Lancet, 25 febbraio 2021.