COVID-19: Un’analisi del rischio di contagio nei diversi luoghi e strategie “smart” per mitigarlo
Nonostante che gli articoli scientifici sul COVID-19 pubblicati nel corso di un anno di pandemia siano ormai dell’ordine di oltre 100.000, purtroppo da un’analisi veloce di alcuni dei principali database scientifici (PubMed, medRxiv, bioRxiv, etc.) usando parole chiave tipo “Comparison risk SARS-CoV-2 Covid infection different places” – o similari – non sembrano esservi, in letteratura, studi che affrontino in maniera comparata il rischio del contagio nei vari luoghi (casa, scuola, ufficio, negozi, mezzi di trasporto, etc.) né, tantomeno, che aiutino a capire la potenziale gravità della malattia se l’infezione è contratta in un luogo piuttosto che in un altro. Infatti, l’approccio più naturale al problema è quello basato sul “contact tracing”, che avrebbe però richiesto la raccolta di una grande mole di dati (parte dei quali tramite un’app di tracciamento via GPS) e l’incrocio con una vastità di informazioni personali che nei Paesi occidentali – Italia in testa – è ostacolata dalla normativa sulla privacy. Un altro approccio al problema è quello basato sulla sieroprevalenza, che è stato usato dall’Istat e dal Ministero della Salute; ma esso fornisce informazioni solo di tipo indiretto e comunque non considera i trasporti e la scuola, né spiega le ragioni per cui si corre un rischio di contagio maggiore in un luogo piuttosto che in un altro. Il presente articolo, perciò, vuole essere un tentativo (il primo a me noto) di affrontare il problema in maniera quantitativa attraverso un semplice modello del fenomeno, che si basa sui quattro parametri davvero rilevanti: (1) il volume di un ambiente indoor, (2) il numero di persone che lo occupano, (3) il tempo che vi si trascorre, (4) il tasso di ricambio dell’aria. I risultati quantitativi e comparati ottenuti grazie all’ipotesi semplificativa che le persone indossino la mascherina (eccetto che in casa) sembrano predire in maniera molto attendibile i rischi di infezione associati, nel caso italiano, ai vari tipi di ambienti, trasporti e scuola compresi (ad es. vi è un perfetto accordo con i rapporti dell’ISS e dell’Istat per quanto riguarda i luoghi che risultano essere più a rischio). Infine, entrando nel dettaglio delle questioni chiave, il presente lavoro illustra – anche con l’aiuto della vasta letteratura sul tema e di alcune tabelle riassuntive – le varie strategie idonee nelle politiche di risposta al Covid-19 per ridurre il numero di contagi e il rischio di malattia grave, spiegando perché queste siano per il Paese preferibili a quelle che sono state adottate nel recente passato dalle Autorità.
Il legame fra dose virale, probabilità di contagio e gravità della malattia
È più di un anno che si parla della pandemia di Covid-19, ma gli italiani continuano a chiedersi dove i contagi avvengano con maggiore probabilità, e dunque quali siano i luoghi da evitare e/o in cui occorre adottare le maggiori precauzioni. Si noti che questa è solo una “dimensione” del problema. Infatti, una seconda “dimensione” è rappresentata dalla gravità della malattia che il contagiato svilupperà, la quale è legata – a parità di altri fattori (come ad es. l’età e le condizioni della persona) – alla “dose” di virus assorbita, in particolare tramite la respirazione (la letteratura scientifica peer reviewed sul legame fra dose virale assorbita e gravità della malattia è accennata nel penultimo paragrafo del presente articolo). Ciò pone una seconda domanda chiave: dove rischio di prendermi la forma più grave?
Come ho illustrato anche in un mio precedente articolo [1], ogni virus ha la capacità di sopravvivere per un certo tempo nell’ambiente all’interno del fluido corporeo (ad esempio di una gocciolina emessa parlando), ma è necessaria la presenza di una cosiddetta “dose virale minima” per produrre realmente l’infezione, o contagio, negli esseri umani: ad es. sono sufficienti circa 100 particelle virali nel caso del norovirus [2] – il virus a RNA responsabile della diarrea – ma tale quantità minima è diversa da virus a virus. Per il SARS-CoV-2 non è nota esattamente, poiché gli esperimenti in tal senso non sono considerati eticamente accettabili.
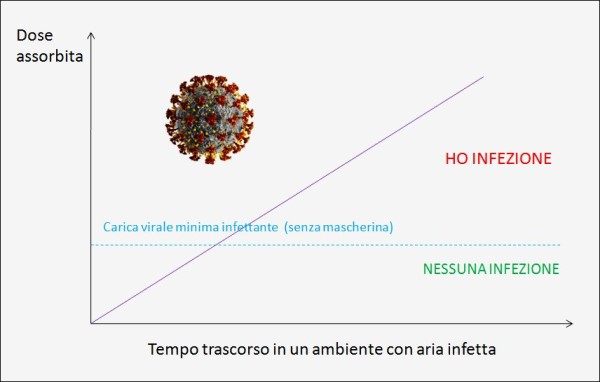
Diversamente, la “carica virale” è un’espressione numerica della quantità di virus presente in un dato volume di fluido corporeo (ad es. l’espettorato, il plasma sanguigno, etc.). La carica virale, in pratica, si riferisce al numero di particelle virali trasportate da un individuo infetto [29]. Quando respiriamo aria infetta – ad esempio perché contenente goccioline (droplet) con il virus al loro interno – assorbiamo una certa dose di carica virale, che è data dal prodotto della carica virale assorbita nell’unità di tempo per il tempo di esposizione. Dunque, più tempo siamo esposti alla sorgente (senza adeguate protezioni e precauzioni) e maggiore è la probabilità di raggiungere la dose virale minima infettante.
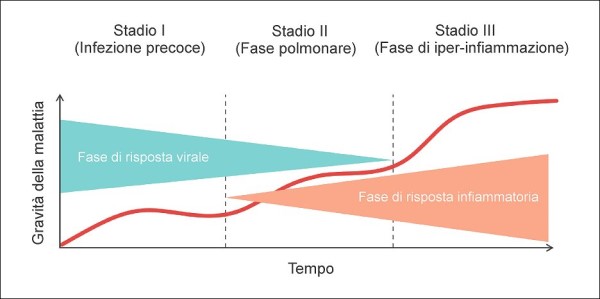
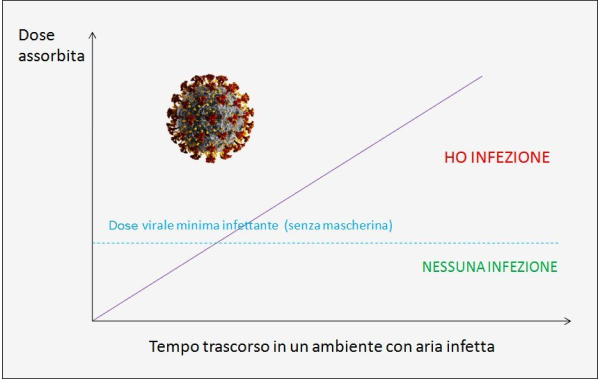 Figura 1. Più tempo si trascorre in un ambiente chiuso o semichiuso con aria infetta dal virus e più grande è la dose virale assorbita da una persona sana, per cui maggiori sono le probabilità di infettarsi, a parità di altre condizioni. L’uso della mascherina, se questa è scelta e indossata correttamente, può abbattere quindi di molto la probabilità di contagio e, quando anche quest’ultimo si verificasse, la barriera costituita dalla mascherina permette comunque di assorbire una dose virale inferiore, riducendo il rischio di forme gravi di malattia, sempre naturalmente a parità di altre condizioni. (fonte: elaborazione dell’Autore)
Figura 1. Più tempo si trascorre in un ambiente chiuso o semichiuso con aria infetta dal virus e più grande è la dose virale assorbita da una persona sana, per cui maggiori sono le probabilità di infettarsi, a parità di altre condizioni. L’uso della mascherina, se questa è scelta e indossata correttamente, può abbattere quindi di molto la probabilità di contagio e, quando anche quest’ultimo si verificasse, la barriera costituita dalla mascherina permette comunque di assorbire una dose virale inferiore, riducendo il rischio di forme gravi di malattia, sempre naturalmente a parità di altre condizioni. (fonte: elaborazione dell’Autore)
I fattori che determinano il raggiungimento o meno della dose minima infettante – e dunque la probabilità di contagio da SARS-CoV-2 – sono però molti e includono, oltre al tempo di esposizione: (1) se il contagiante è asintomatico o se invece ha dei sintomi (come ad es. una tosse, che può diffondere una elevata quantità di goccioline infettive); (2) il comportamento dell’individuo infetto (respira solo, parla, starnutisce, tocca oggetti o superfici, etc.); (3) il comportamento della persona sana (modello di contatto con persone / cose infette, uso di dispositivi di protezione individuale, etc.); (4) i fattori ambientali (ambiente chiuso/aperto e, se è chiuso, suo volume, livello di ventilazione, di ricambio aria, di particolato, etc.).
Inoltre, come per qualsiasi altro agente patogeno (batteri, funghi, etc.) o veleno, i virus sono di solito più pericolosi quando si presentano in quantità maggiori. Sola dosis venenum facit, ovvero “è la dose che fa il veleno”, dicevano i latini e il concetto si applica, mutatis mutandis, anche ai virus. “Piccole esposizioni iniziali tendono a portare a infezioni lievi o asintomatiche, mentre dosi più grandi possono risultare letali”, come ha spiegato molto bene il professore di chimica e genomica Joshua Rabinovitz. Dunque, di quante più volte si eccede la dose infettante minima, tanto più si rischia di sviluppare una forma grave.
Pertanto, per proteggersi dal Covid-19 – sia dal punto di vista del contagiarsi o meno, sia di sviluppare una forma grave della malattia – occorre cercare di prevenire l’esposizione ad alte dosi di virus (questo secondo importante aspetto verrà discusso in modo ampio verso la fine di questo articolo sulla base della letteratura peer reviewed, quindi per il momento chiedo al lettore di darlo per acquisito). In effetti, intuiamo tutti facilmente che entrare per pochi minuti in un palazzo di uffici in cui qualcuno è stato con il coronavirus non è così pericoloso come sedersi accanto a quella persona per due ore in treno, e ciò sia dal punto di vista della probabilità di contagio che, appunto, della gravità dell’eventuale malattia. Perciò, la durata breve dell’esposizione – così come l’uso di mascherine e di guanti, il distanziamento sociale, una corretta igiene, etc. – sono tutte cose che aiutano a ridurre di molto la dose di virus che possiamo inalare.
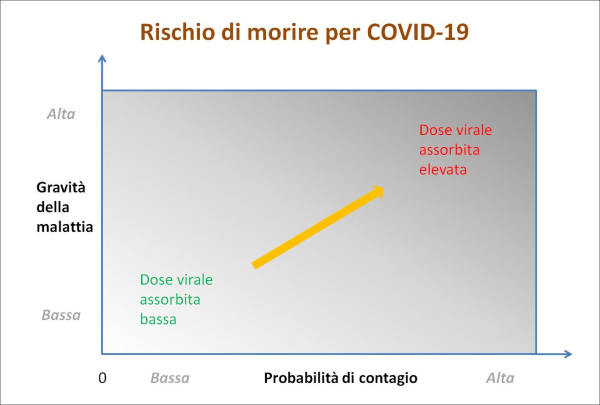 Figura 2. Il rischio per una persona (sana e non vaccinata) di morire per COVID-19 dipende, a parità di altre condizioni, da due parametri su cui possiamo avere un certo controllo: (1) la probabilità di contrarre un’infezione e (2) la gravità della malattia, che sono entrambi legati, oltre ad altri fattori di rischio (età, comorbidità e carenza di vitamina D), alla dose virale assorbita, la quale varia da luogo a luogo frequentato e dipende da una serie di altre variabili, fra cui il comportamento della persona in questione e quello altrui (in particolare riguardo all’uso o meno di mascherine), come verrà discusso in dettaglio nella penultima sezione del presente articolo sulla base della letteratura peer reviewed. Pertanto, il rischio in questione può essere rappresentato in due dimensioni con un semplice diagramma cartesiano, in cui i luoghi con alta probabilità di contagio ed elevata gravità della malattia (ovvero con elevata dose virale assorbita) si collocheranno in alto a destra, mentre quelli con bassa probabilità di contagio e bassa gravità della malattia (ovvero con bassa dose virale assorbita) si collocheranno in basso a sinistra. Dunque, la dose virale assorbita costituisce un fattore chiave di rischio sul quale possiamo agire. (fonte: elaborazione dell’Autore)
Figura 2. Il rischio per una persona (sana e non vaccinata) di morire per COVID-19 dipende, a parità di altre condizioni, da due parametri su cui possiamo avere un certo controllo: (1) la probabilità di contrarre un’infezione e (2) la gravità della malattia, che sono entrambi legati, oltre ad altri fattori di rischio (età, comorbidità e carenza di vitamina D), alla dose virale assorbita, la quale varia da luogo a luogo frequentato e dipende da una serie di altre variabili, fra cui il comportamento della persona in questione e quello altrui (in particolare riguardo all’uso o meno di mascherine), come verrà discusso in dettaglio nella penultima sezione del presente articolo sulla base della letteratura peer reviewed. Pertanto, il rischio in questione può essere rappresentato in due dimensioni con un semplice diagramma cartesiano, in cui i luoghi con alta probabilità di contagio ed elevata gravità della malattia (ovvero con elevata dose virale assorbita) si collocheranno in alto a destra, mentre quelli con bassa probabilità di contagio e bassa gravità della malattia (ovvero con bassa dose virale assorbita) si collocheranno in basso a sinistra. Dunque, la dose virale assorbita costituisce un fattore chiave di rischio sul quale possiamo agire. (fonte: elaborazione dell’Autore)
Oltre alla dose virale assorbita, gli altri fattori di rischio noti che caratterizzano un esito infausto nel COVID-19 sono i seguenti tre: (1) l’età, dato che ben l’85% delle vittime italiane hanno più di 70 anni (e circa il 95% delle vittime ha più di 60 anni); (2) la presenza di comorbidità (anche i pochi morti italiani sotto i 40 anni – nonché le vittime per Covid-19 che si osservano fra i vaccinati secondi i dati forniti da Israele – presentano, nella maggior parte dei casi, gravi patologie preesistenti: cardiovascolari, renali, psichiatriche, diabete, obesità [3]); (3) la carenza di vitamina D (nel sangue), come evidenziato da numerosi studi nel mondo [4, 5]; l’argomento è stato largamente illustrato in un mio precedente articolo [4]. Quest’ultimo fattore e la dose virale assorbita sono dunque i soli fattori sui quali si può agire.
La domanda “da un milione di euro” sul COVID-19: quali sono i luoghi più a rischio?
Per quanto l’informazione su quali siano i luoghi più a rischio per il contagio da SARS-CoV-2 sia ovviamente preziosissima per i decisori politici e sanitari, la letteratura a riguardo è in realtà scarsissima e può essere riassunta agevolmente nelle poche righe di questa sezione. Mentre, infatti, alcuni studi hanno indagato la trasmissione del coronavirus in un particolare tipo di luogo (autobus, ristorante, etc.) ed altri hanno analizzato in modi più o meno originali i dati epidemiologici raccolti, che io sappia nessun team di ricerca si è concentrato sul confronto quantitativo del rischio di contagio nei diversi possibili luoghi (questo non vuol dire necessariamente che non esistano studi effettuati dalle Autorità sanitarie in qualche altro Paese, ma semplicemente che non ne ho trovati sui database degli articoli scientifici pubblicati e su quelli dei preprint, né ho mai letto news su pubblicazioni a riguardo – eccetto quelle che citerò in questo articolo – pur seguendole quotidianamente già da prima dell’arrivo in Italia della pandemia).
Per capire il motivo di quest’assenza (o almeno, ripeto, apparente assenza) di studi peer reviewed pubblicati, occorre comprendere come si determina in realtà il “rischio” di un luogo rispetto a un altro riguardo la possibilità di contagiarsi. Il modo più semplice può sembrare, in teoria, quello epidemiologico: osservando, cioè, quante persone si contagiano in un certo posto (ad esempio, a casa), quante in un altro, e così via. Ciò lo si potrebbe fare tramite un’app di tracciamento che sfrutti la geolocalizzazione GPS (ma l’Europa vi ha rinunciato) oppure analizzando la catena dei contagi caso per caso. In questo modo si può stilare una classifica dei posti in cui ci si contagia di più.
Questa la troviamo “abbozzata” in un rapporto del gennaio 2021 dell’Istituto Superiore di Sanità (ISS), intitolato “Apertura delle scuole e andamento dei casi confermati di SARS-CoV-2: la situazione in Italia” [6]: secondo questo rapporto, i primi tre contesti di trasmissione nel nostro Paese sono, nell’ordine, il contesto familiare/domiciliare, quello sanitario/assistenziale e quello lavorativo (tradotto in luoghi: casa, ospedali/RSA e uffici). Guarda caso, si tratta proprio dei tre luoghi dove si passano grandi quantità di tempo, sebbene la casa si distingua dagli altri due perché non vi si usano le mascherine e un ospedale si distingua, invece, per il gran numero di infetti da Covid-19 di solito in esso presenti.
Tuttavia, quello dell’ISS, non fornendo informazioni quantitative ma solo una “classifica” – e non esprimendo quest’ultima la percentuale di casi di contagio rispetto alla popolazione esposta che si trova in quei luoghi, bensì solo la percentuale di contagiati totali che si sono infettati in quel determinato contesto – non è un vero e proprio confronto. In pratica, è un po’ come se dicessimo che un vaccino A è più pericoloso di un vaccino B solo confrontando il numero di morti associati e non, invece, i rispettivi tassi di mortalità ottenuti dividendo il numero di morti associati per il numero di dosi somministrate.
Con il metodo usato dall’ISS, anche lo pseudo-confronto fra luoghi diversi è, di fatto, impossibile se prendiamo in considerazione luoghi dove si trascorre un tempo relativamente ridotto, come ad esempio una farmacia in cui andiamo magari una volta al mese standovi poco più di 15 minuti: l’unico modo per poter sperare di stimare sul campo – ovvero con l’approccio epidemiologico – il numero di contagi in tutti i vari possibili luoghi è quello di usare un’app ad hoc con tracciamento GPS. In alternativa, per fare un confronto reale si possono sviluppare dei modelli (e poi fare una simulazione con il computer) che tengano conto delle principali variabili rilevanti al problema, come farò nel seguito di questo articolo.
Infine, vorrei sottolineare come il già citato rapporto di 39 pagine dell’ISS [6] giunga alla conclusione che “le scuole non rappresentano i primi tre contesti di trasmissione in Italia”. Ma ciò, sostanzialmente, nulla ci dice a livello quantitativo (cioè non dà i numeri assoluti né, ovviamente, stima il rischio di infezione nei quattro contesti in questione), e non vi è alcuna valutazione della trasmissione associata ai mezzi di trasporto o ad altri luoghi. Oltretutto, come mi ha confidato un esperto di igiene e medicina preventiva, “analisi svolte in altri Paesi hanno dimostrato che la frequenza delle infezioni è stata molto più elevata nelle scuole che non altrove; da noi essa è apparsa bassa verosimilmente per una sottostima di quanto avvenuto negli altri ambienti, in cui è stato fatto un tracciamento davvero poco rigoroso”. Non vi è quindi da meravigliarsi se le chiusure imposte in Italia nel 2020 per contenere la pandemia siano apparse a molti incomprensibili, essendo state prese sulla base di dati lacunosi e affetti da gravi bias.
Come spiega in un articolo la testata Pagella politica [50], “nel 2020 il Ministero dell’Istruzione aveva avviato un monitoraggio sui contagi nelle scuole a fine settembre, solo alcune settimane dopo l’inizio della scuola, per poi concluderlo dopo nemmeno un mese, senza comunicare pubblicamente i risultati. Successivamente, però, il monitoraggio non è più ripreso. A gennaio 2021, durante un’audizione al Comitato tecnico scientifico (CTS), il matematico Stefano Merler della Fondazione Bruno Kessler (FBK) – un ente di ricerca di interesse pubblico che collabora con l’Istituto superiore di sanità (ISS) – aveva spiegato che è di fatto impossibile quantificare l’impatto della scuola sull’epidemia e valutare la trasmissibilità del contagio perché non ci sono dati sui contagi avvenuti in classe”. Insomma, fin dall’inizio la scuola è stata, per le nostre Autorità, uno dei numerosi “talloni d’achille” nella gestione della pandemia.
Prima del citato rapporto dell’ISS, era stato l’Istat a fornire, nell’agosto 2020, in un proprio rapporto [58, 59] qualche dato relativo alle categorie che hanno contratto di più o di meno il Covid (anche in forma asintomatica o pauci-sintomatica, ovvero subclinica, tale cioè da sfuggire alle rilevazioni ufficiali) a seconda del settore di attività economica, avendo diffuso in quell’occasione i primi risultati (relativi a 64.660 persone residenti in Italia) sull’indagine di sieroprevalenza del SARS-CoV-2, che mirava a definire la proporzione di persone nella popolazione generale che hanno sviluppato una risposta anticorpale contro il SARS-CoV-2, attraverso la ricerca di anticorpi specifici nel sangue. Tuttavia, questo studio – i cui risultati in sostanza concordano con quelli del citato rapporto dell’ISS – non risponde se non indirettamente e molto parzialmente alla nostra domanda iniziale (non considera, ad esempio, i mezzi di trasporto, le scuole, etc.), e tanto meno spiega i motivi per cui si sono trovati valori diversi in luoghi diversi.
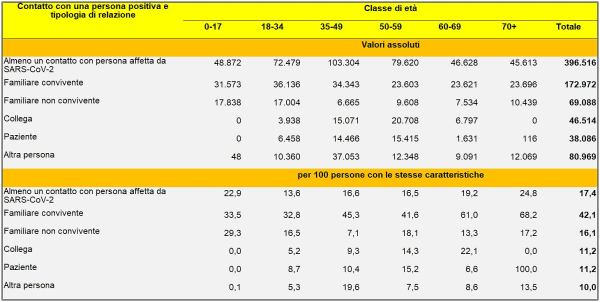 Una delle tabelle dello studio dell’Istat, relativa alle “Persone positive al test di sieroprevalenza SARS-CoV-2 per contatto con una persona positiva, tipologia di relazione e classe di età. Nella parte bassa della tabella, si può notare come il tasso risulti parecchio elevato per i familiari conviventi: un risultato perfettamente in linea con quanto ho trovato, relativamente al rischio di contagio nei diversi luoghi, con il mio simulatore di dose virale assorbita che verrà illustrato nel presente articolo (fonte: Tavole del Rapporto Istat [59]
Una delle tabelle dello studio dell’Istat, relativa alle “Persone positive al test di sieroprevalenza SARS-CoV-2 per contatto con una persona positiva, tipologia di relazione e classe di età. Nella parte bassa della tabella, si può notare come il tasso risulti parecchio elevato per i familiari conviventi: un risultato perfettamente in linea con quanto ho trovato, relativamente al rischio di contagio nei diversi luoghi, con il mio simulatore di dose virale assorbita che verrà illustrato nel presente articolo (fonte: Tavole del Rapporto Istat [59]
Nella Sanità, secondo il rapporto Istat, si è registrata la sieroprevalenza più alta, con il 4,5% (anche questo risultato è perfettamente in linea con quelli forniti dal mio simulatore, sebbene la pericolosità di ospedali e RSA sia dipesa da una gestione errata dei malati Covid). Gli occupati in settori essenziali e attivi durante la pandemia non hanno presentano valori significativamente più elevati (2,8%) rispetto alla popolazione generale se confrontati con gli occupati in settori di attività economiche sospese (2,7%). Un dato ha riguardato i servizi di ristorazione e accoglienza, in corrispondenza dei quali la prevalenza è risultata del 3,4%. Sul versante dei non occupati il tasso medio di sieroprevalenza si è attestato al 2,1% per le casalinghe, al 2,6% per i ritirati dal lavoro, al 2,2% per gli studenti e all’1,9% per le persone in cerca di lavoro. Tuttavia, il rapporto nulla ci dice sul rischio (comparato) di contagio nelle scuole, nei trasporti, etc. Sappiamo solo che, per i bambini da 0 a 5 anni, il tasso medio è stato dell’1,3% sotto la media e per gli anziani over 85 dell’1,8% sotto la media, per il probabile effetto di protezione da parte dei familiari e per l’autotutela.
I luoghi “superdiffusori” e l’importanza di limitare l’occupazione massima
Un importante studio scientifico pubblicato a gennaio su Nature [7] ha mostrato il forte legame fra mobilità delle persone e trasmissione virale semplicemente usando, per 10 grosse aree metropolitane degli Stati Uniti, un database di dati di geolocalizzazione delle persone fornito dalle compagnie di telefonia mobile, che mappa gli spostamenti orari di circa 100 milioni di persone verso una serie di “Punti di Interesse” (ristoranti, grandi magazzini, negozi vari, etc.). Non dimentichiamo, infatti, che il virus SARS-CoV-2, da solo, non si muove certo su grandi distanze, ma viaggia lontano grazie alle nostre gambe ed ai mezzi di trasporto che ci fanno muovere rapidamente da un posto all’altro di una città o di una nazione.
Ma, soprattutto, il lavoro in questione è assai interessante in quanto mostra come certi luoghi (chiamati per l’appunto dagli autori POI, Point of Interest, o “punti di interesse”) contribuiscano assai più di altri alle infezioni totali – e dunque pongano un rischio per “(ri)apertura” più alto – perché la densità di visite in quei posti è più alta (fig.3b) e/o perché la gente vi sta più tempo (fig.3a). In pratica, i principali POI o luoghi “superspreader” (superdiffusori, per usare il termine italiano) sono: ristoranti, palestre, hotel, bar, luoghi religiosi. Fra questi, i ristoranti pongono un rischio (come intera categoria) particolarmente alto, circa 3 volte maggiore rispetto alla categoria di POI con il rischio più alto dopo i ristoranti (fig.3d).
Se però si va poi a stimare il rischio relativo del tenere aperto o del riaprire un singolo POI – ovvero i numeri di infezioni previsti sommati su tutti i POI nella categoria vengono divisi per il numero di POI presenti nelle 10 aree metropolitane considerate – i rischi relativi dopo la normalizzazione per numero di POI risultano essere sostanzialmente simili per le varie categorie (fig.3c). Inoltre, il modello prevede che il tasso di infezione sia più alto fra le persone più svantaggiate dal punto di vista socio-economico, sia perché queste riducono di meno la loro mobilità (in Italia si pensi ad es. agli immigrati) sia perché si recano più spesso in negozi di cibo e in altri posti a rischio rispetto alle persone ad alto reddito.
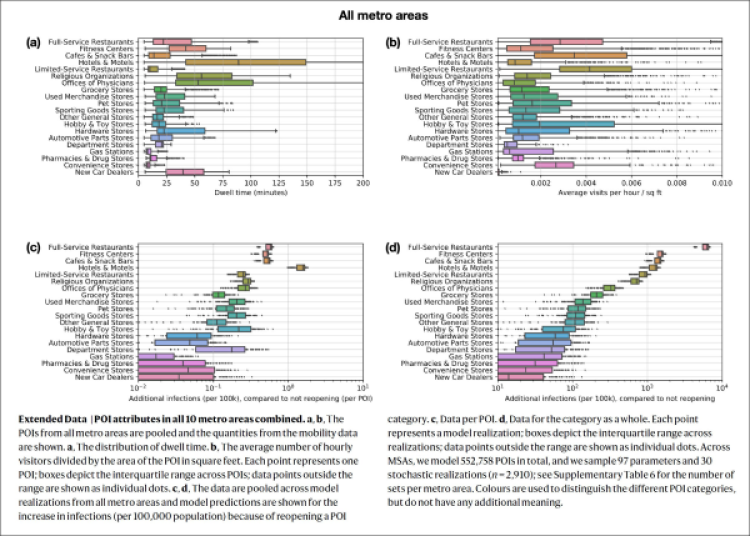 Figura 3. Essa mostra (a) il tempo di permanenza delle persone nei vari Punti di Interesse (POI) e (b) il numero medio di visite orarie / piede quadrato nel POI. Sono poi mostrate le infezioni aggiuntive per ogni 100.000 rispetto alla non riapertura (c) per singolo POI e (d) per la categoria merceologica del POI nel suo complesso. Ricordo che lo studio in questione si riferisce agli Stati Uniti. (fonte: Chang et al. [7])
Figura 3. Essa mostra (a) il tempo di permanenza delle persone nei vari Punti di Interesse (POI) e (b) il numero medio di visite orarie / piede quadrato nel POI. Sono poi mostrate le infezioni aggiuntive per ogni 100.000 rispetto alla non riapertura (c) per singolo POI e (d) per la categoria merceologica del POI nel suo complesso. Ricordo che lo studio in questione si riferisce agli Stati Uniti. (fonte: Chang et al. [7])
Una scoperta rilevante dello studio è che ridurre la massima occupazione di un ambiente (mezzo di trasporto, supermercato, etc.) riduce il rischio senza ridurre la mobilità delle persone: il limitare del 20% l’occupazione massima dei “Punti di interesse” (POI) nell’area metropolitana di Chicago ha ridotto, nel modello, il numero di infezioni previste dell’80%, con una perdita del 42% delle visite complessive. Si noti che ciò è l’opposto di quanto si è fatto in Italia, dove i centri commerciali sono stati chiusi nei week-end, le corse degli autobus sono state ridotte con la chiusura delle scuole, etc., invece di ridurre al minimo il tasso di occupazione consentito al chiuso e aumentare al massimo orari di apertura e corse.
Questo risultato “evidenzia la non linearità del numero di infezioni previsto in funzione del numero di visite: si può ottenere una riduzione sproporzionatamente grande delle infezioni con una piccola riduzione delle visite. Inoltre, il ridurre l’occupazione massima consentita ha sempre portato, nel modello, a un minor numero di infezioni previste per lo stesso numero di visite totali. Ciò si verifica perché, riducendo le occupazioni massime, si sfrutta la densità di visita variabile nel tempo all’interno di ciascun POI, riducendo in modo sproporzionato le visite a questi luoghi durante i periodi ad alta densità (con il rischio più alto), mentre le visite rimangono invariate nei periodi a bassa densità (con rischi inferiori)”.
“Questi risultati” – concludono gli Autori della ricerca – “supportano i risultati precedenti che precisi interventi, come ridurre la capienza massima, possono essere più efficaci di misure meno mirate, comportando inoltre costi economici sostanzialmente inferiori” [8]. In un mio precedente articolo, intitolato “Il ‘boom’ dei prezzi e l’impatto dei lockdown: l’Italia rischia ora la ‘tempesta perfetta’”, ho mostrato come, in effetti, l’impatto economico dei lockdown in Italia sia stato devastante [9] per tutta una serie di ragioni, e come il peggio da noi non sia affatto scongiurato se si considera il contesto internazionale, con gli enormi squilibri di prezzi e di mercato innescati dalla pandemia. La strategia del limitare l’occupazione massima avrebbe consentito di mitigare quest’impatto tutt’altro che secondario e di non dover chiudere per mesi intere attività in modo indiscriminato, come invece è stato fatto.
Le modalità di trasmissione del contagio di SARS-CoV-2 fra le persone
Certamente, i fattori che rendono un luogo più a rischio di un altro sono numerosi e il tasso di occupazione è solo uno di essi. Sappiamo infatti che l’esposizione ad alte dosi di SARS-CoV-2 (che implica maggior rischio di infezione) è più probabile nelle interazioni ravvicinate fra le persone, come nel corso di riunioni o in bar affollati, o nel toccarsi il naso o la bocca dopo aver ricevuto quantità sostanziose di virus sulle mani. Le ricerche sperimentali hanno mostrato che le interazioni interpersonali sono più pericolose in spazi chiusi piccoli e a breve distanza, con un’escalation nelle dosi che aumenta con il tempo di esposizione. Ma per tradurre tutto ciò in numeri occorre sviluppare un semplice modello del fenomeno.
Prima, però, il fenomeno occorre capirlo bene. L’Organizzazione Mondiale della Sanità (OMS) utilizza un diametro delle particelle di 5 μm per distinguere fra la trasmissione dei virus per via aerea (<5 μm), o aerosol, e quella tramite goccioline (>5 μm), o droplet. Alcuni studi suggeriscono che le particelle superiori a 6 μm tendono a depositarsi principalmente nelle vie aeree superiori, mentre le particelle inferiori a 2 μm si depositano principalmente nelle regioni alveolari [10]. Pertanto, le particelle inferiori a 10 μm possono penetrare più in profondità nel tratto respiratorio e hanno più probabilità di veicolare un virus nella regione polmonare inferiore, dove sappiamo che il SARS-CoV-2 può fare il maggior danno.
L’attività respiratoria comporta l’emissione di particelle di dimensioni variabili, con una distribuzione che dipende dalle condizioni di emissione. Poiché la probabilità che una gocciolina contenga virioni (cioè singole particelle virali) è, a parità di altre condizioni, legata al suo volume, ne deriva che in aria il SARS-CoV-2 può essere veicolato senz’altro attraverso “grosse goccioline” che ricadono rapidamente al suolo. Una parte delle unità virali, però, può essere emessa attraverso “goccioline medie e piccole” che, per le loro dimensioni, possono persistere in aria per un tempo prolungato, come aerosol. Queste, essendo anche assai più numerose [28], possono quindi costituire un ulteriore canale di trasmissione del contagio (che però diventa il canale di gran lunga più importante quando le persone indossano le mascherine).
Dunque, il canale di trasmissione del contagio da SARS-CoV-2 ritenuto principale è mediante droplet – ovvero goccioline di secrezioni respiratorie prodotte tossendo, starnutendo, parlando, respirando – ma il contagio può avvenire pure tramite aerosol. Un esperimento effettuato dall’Istituto per le Malattie infettive americano (NIAD) [11, 12] ha mostrato come il virus SARS-CoV-2 possa rimanere sospeso nell’aria, sotto forma di aerosol, fino a 3 ore o più; mentre, secondo un altro studio [51], può rimanervi addirittura fino a 16 ore. Tuttavia, se la persona che emette l’aerosol infetto nell’aria abbandona la stanza, la quantità di virus si dimezza nel giro di un’ora. Inoltre, le droplet depositate sulle superfici (ad es. metalliche) possono conservare il virus – in quantità sempre più ridotte – fino a 72 ore.
In pratica, la trasmissione del SARS-CoV-2 da persona a persona avviene mediante droplet in due casi [13]: (1) quando la distanza è ravvicinata (1-2 metri) e le droplet provenienti da una persona infetta vengono direttamente a contatto con le mucose (bocca, occhi, naso) di un soggetto recettivo oppure (2) indirettamente, dopo aver toccato con le mani oggetti contaminati (chiamati “fomiti”) attraverso le droplet che vi si sono depositate sopra. Tuttavia, le goccioline con diametri aerodinamici più piccoli percorrono distanze maggiori nella forma di aerosol (denominati bioaerosol) e di conseguenza questi provocano la trasmissione per via aerea della malattia se vengono inalati in quantità.
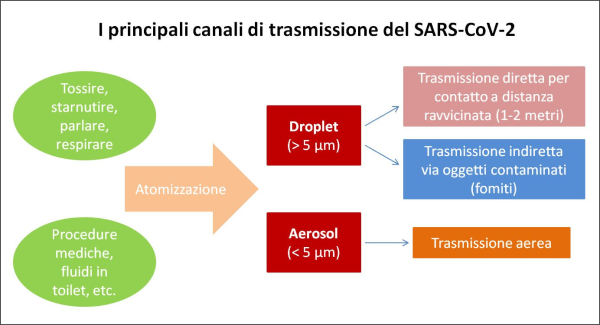 Figura 4. I due principali canali di trasmissione del virus SARS-CoV da una persona all’altra. Le mascherine fermano le droplet ma non tutte le particelle di aerosol, che dunque in tal caso diventano il principale canale di trasmissione. (fonte: elaborazione dell’Autore sulla base dei paper scientifici citati nel testo) [13].
Figura 4. I due principali canali di trasmissione del virus SARS-CoV da una persona all’altra. Le mascherine fermano le droplet ma non tutte le particelle di aerosol, che dunque in tal caso diventano il principale canale di trasmissione. (fonte: elaborazione dell’Autore sulla base dei paper scientifici citati nel testo) [13].
Nel caso del Covid-19, anche sulla base di studi del passato (quando – si parla di molti decenni fa – si aveva difficoltà a rivelare strumentalmente goccioline molto piccole, cosa oggi invece fattibile ad es. grazie a laser, PC, etc.) si è all’inizio ritenuto che fossero prevalentemente le droplet a trasmettere la malattia rispetto agli aerosol. Pertanto, la ricerca si è concentrata maggiormente sul ruolo e sul meccanismo di trasmissione delle droplet. Tuttavia, recenti evidenze supportano l’ipotesi che anche gli aerosol giochino un ruolo importante nella trasmissione del SARS-CoV-2 [14, 15]. Anzi, si ritiene che gli aerosol rappresentino un rischio di infezione addirittura maggiore rispetto alle droplet per le persone suscettibili poste a più grande distanza rispetto al raggio di caduta (di circa 2 metri) delle goccioline più pesanti.
La particelle di aerosol espirate vengono trasportate (cioè spostate), in un ambiente chiuso vuoto e isolato, ma non tanto dal processo di diffusione (come quello di un profumo in una stanza), che è molto lento in quanto la velocità di diffusione è inversamente proporzionale al quadrato del diametro delle particelle, per cui una piccola particella di aerosol da 1 μm di diametro percorre 0,002 m/sec, ovvero 7 metri in un’ora. Sono le correnti d’aria, la ventilazione forzata per il ricambio d’aria con l’esterno, il ricircolo dell’aria (ove presente un sistema di climatizzazione a pompa di calore), nonché il movimento delle persone, a far sì che lo spostamento nell’aria delle particelle contenenti il virus sia assai più rapido e turbolento.
Come l’ing. Giorgio Buonanno, professore associato all’Università di Cassino, ha spiegato in un ottimo articolo dal significativo titolo Come il mito dei droplets ha sostituito (fino ad oggi) la trasmissione aerea, che peraltro trovate su questo stesso sito web [54], “l’importanza della trasmissione aerea (cioè tramite aerosol, ndr) è stata inizialmente negata con forza dall’Organizzazione Mondiale della Sanità (OMS) e dalla maggior parte delle organizzazioni di sanità pubblica [60]. L’OMS ha gradualmente ammorbidito la sua posizione dichiarando solo il 30 aprile 2021 che la trasmissione aerea del SARS-CoV-2 è importante [61]. La lenta risposta delle principali organizzazioni di sanità pubblica nel rivedere la comprensione della trasmissione del SARS-CoV-2 è sconcertante e tragica, poiché non c’è dubbio che questi ritardi abbiano contribuito a uno scarso controllo della pandemia e ad una crescita di contagi e di morti”.
L’articolo di Buonanno prosegue illustrando perché queste organizzazioni hanno mostrato così tanta resistenza al cambiamento, per cui ne raccomando la lettura. Ma mi si consenta di citare un altro estratto dal suo lavoro, tanto per dare il “sapore” della situazione: “[..] Negli ultimi decenni, con antibiotici, vaccini e nessuna grande pandemia, questi dettagli sulla trasmissione non hanno rappresentato una priorità. Gli esperti di droplets avevano il controllo di tutte le istituzioni chiave e potevano ignorare i pochi sostenitori della trasmissione aerea. Se ad es. un collega avesse scritto una proposta di ricerca per finanziare uno studio sulla trasmissione aerea, i revisori anonimi avrebbero rispedito la domanda al mittente perchè “la trasmissione aerea non è importante, quindi non si dovrebbero sprecare fondi per questo”.
E ancora, sempre dal suddetto articolo di Buonanno: “Nel febbraio 2020, sembrava che gli esperti di trasmissione aerea fossero molto timidi, nonostante le prove significative a favore. Nel frattempo l’OMS dichiarava con sicurezza, il 28 marzo 2020, che [62]: “FATTO: IL COVID NON È AIRBORNE, e dire che si trasmette per via aerea è DISINFORMAZIONE, aiutate @WHO a combattere! [..] La prof. Lidia Morawska ha organizzato un gruppo internazionale di scienziati, di cui faccio parte, che ha trascorso l’ultimo anno a lavorare su questo tema. Ed anche se la teoria dei droplets sta affondando, il nostro lavoro non è finito. [..] Ma oltre a cambiare la storia della scienza, la pandemia da Covid-19 può cambiare anche la nostra visione. È tempo di mettere in sicurezza l’aria che respiriamo negli ambienti chiusi”.
Verso un modello per confrontare il rischio di contagio (e la potenziale gravità del Covid) nei vari luoghi
In realtà, stimare il rischio relativo di contagio in diversi luoghi chiusi non è così difficile come potrebbe sembrare a prima vista, se si utilizza un modello semplificato appropriato. Infatti, i parametri principali da tenere in considerazione nel modello sono: (1) il numero di persone presenti nell’ambiente; (2); il volume di aria contenuto nell’ambiente; (3) il tempo trascorso in quell’ambiente; (4) il tasso di ricambio dell’aria. Di questi quattro parametri, in generale solo i primi tre possono variare in modo davvero rilevante da una situazione all’altra, e quindi colgono bene l’“essenza” del problema (non a caso sono gli stessi tre parametri usati nello studio di Nature appena illustrato, salvo l’uso della superficie al posto del volume).
Difatti, quando si modellizza un fenomeno che si ha difficoltà a osservare direttamente – al fine di comprenderlo meglio ed in maniera quantitativa, e soprattutto allo scopo di fare delle previsioni – poiché non è possibile tener conto (almeno in prima battuta) di tutte le variabili in gioco, occorre fare delle ipotesi semplificative. L’analisi successiva dei risultati ottenuti ci dice se il modello predittivo è affidabile e porta a conclusioni corrette. In caso negativo, occorre raffinare ulteriormente il modello che, una volta raggiunto il livello di affidabilità cercato, rappresenta un potente strumento a disposizione dei decisori.
Purtroppo, a guidarci e ad orientarci nella lotta alla pandemia da SARS-CoV-2 sono stati, inizialmente, teorie ed esperimenti, seppur geniali, datati 1907 e 1930. Infatti, le attuali linee guida sugli impianti di ventilazione/climatizzazione in strutture comunitarie non sanitarie e in ambienti domestici (ad es. ristoranti, scuole o teatri) in relazione alla diffusione del virus SARS-CoV-2 si basano su quei dati ed esperimenti assai vecchi. All’epoca non si riuscivano a visualizzare e monitorare le piccole particelle di aerosol; quel che si vede oggi, anche dai fotogrammi degli esperimenti e dagli attuali tracciamenti, è un pulviscolo di minuscole goccioline, che formano un aerosol. E, con i modelli e le simulazioni in corso di sviluppo, è possibile calcolare la concentrazione di aerosol a differenti distanze e in tempi diversi [31].
La principale ipotesi semplificativa adottata nel nostro modello, come accennavo, è che il tasso di ricambio dell’aria, eccetto due casi “patologici” (scuola e casa) sia simile – entro un fattore 2 o poco più – per i vari “Punti di Interesse” (POI) considerati. Ciò è verosimile poiché, salvo le citate eccezioni, si tratta di luoghi pubblici soggetti alle stringenti normative in materia (ovvero alla norma UNI 10339, in vigore dal 1995 e ora in fase di revisione), che prevedono per attività commerciali ed uffici un afflusso minimo di aria esterna (e quindi anche una corrispondente estrazione di aria dall’ambiente) compreso, a seconda dei casi (v. tabella), fra 9 e 11 x 10-3 mc/sec per persona, pari a circa 0,6 metri cubi/minuto per persona [16].
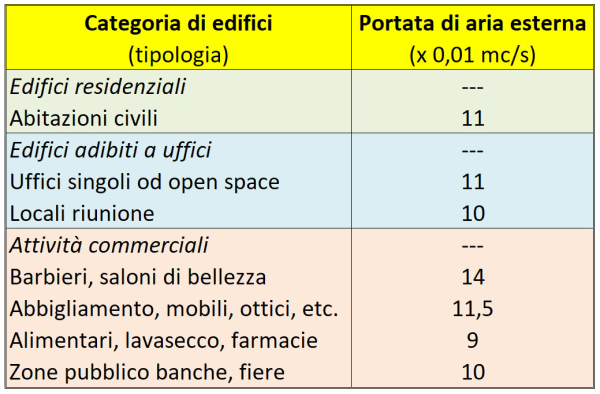 La portata di aria esterna nei vari tipi di edifici ad uso civile prevista, in Italia, dalla norma UNI 10339 [16, 17]. Si noti che 10-3 mc/s = 0,01 mc/s = 3,6 mc/h.
La portata di aria esterna nei vari tipi di edifici ad uso civile prevista, in Italia, dalla norma UNI 10339 [16, 17]. Si noti che 10-3 mc/s = 0,01 mc/s = 3,6 mc/h.
Mentre in alcuni mezzi di trasporto (bus, tram) vi è un’areazione naturale che avviene attraverso l’apertura delle porte alle fermate, negli edifici pubblici (negozi, cinema, etc.) il ricambio d’aria con l’esterno avviene solitamente tramite impianti di Ventilazione Meccanica Controllata (VMC) a recupero di calore e dimensionati sui valori di legge (in modo da garantire il risparmio energetico), i quali possono essere completamente indipendenti oppure integrati nell’impianto di climatizzazione. La già citata norma prevede anche una filtrazione minima dell’aria e una movimentazione dell’aria con velocità entro determinati limiti (da 5 a 15 cm/sec) [17], il tutto per mantenere adeguate caratteristiche di qualità dell’aria.
Consideriamo, a titolo di esempio, il caso di un ufficio open space di 180 mq destinato a call-center. La portata d’aria da immettere / estrarre secondo la norma UNI 10339 è 11 x 10-3 mc/s per persona, pari a 39,6 mc/h per persona. L’affollamento calcolato tramite l’indice di affollamento previsto dalla norma UNI 10339 (v. tabella) è 0,12 persone/mq x 180 mq = 22 persone. Assumendo un affollamento massimo di 25 persone, la portata di aria richiesta è di 25 pers. x 39,6 mc/(h pers.) = 990 mc/h [17]. Se il soffitto è alto 3 m, il volume dell’open space è di 180 mq x 3 m = 540 mc, per cui ho circa due ricambi d’aria all’ora, ovvero circa il doppio di quanto avviene in un’aula scolastica (aprendo le finestre a fine ora).
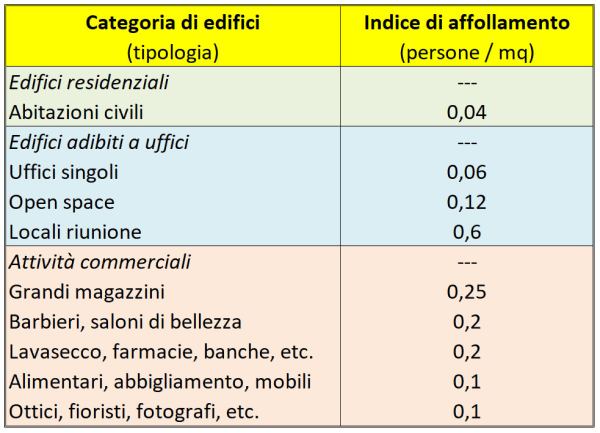 Indice di affollamento nei vari tipi di edifici ad uso civile previsto, in Italia, dalla norma UNI 10339.
Indice di affollamento nei vari tipi di edifici ad uso civile previsto, in Italia, dalla norma UNI 10339.
Tuttavia, mentre in tutte le altre situazioni gestite con un impianto di Ventilazione Meccanica Controllata il ricambio d’aria è continuo – e dunque costante – nel caso di un’aula scolastica non lo è: esso avviene tipicamente solo quando cambia l’insegnante, quindi ogni ora o, a volte, ogni due ore. Anche nelle case il ricambio d’aria, specie d’inverno, avviene di solito 1 o 2 volte al giorno per tot minuti, per ovvie ragioni di climatizzazione e risparmio energetico. Dunque, sia nel caso delle scuole sia delle abitazioni si assiste a un assai rilevante accumulo nell’aria dei virioni emessi sotto forma di aerosol da un eventuale infetto presente. Pertanto, ne dovremo tenere debitamente conto nell’implementare il nostro modello.
Altre informazioni utili e strategie di difesa fornite dagli studi scientifici
La trasmissione di SARS-CoV-2 da una persona infetta avviene principalmente attraverso l’aria nella forma di droplet e particelle di aerosol (più di rado attraverso il contatto con superfici infette). Queste particelle variano nelle loro dimensioni e aerodinamica. Il tasso di trasmissione aerea del SARS-CoV-2 dipende da diversi fattori, come l’origine delle droplet e degli aerosol, la carica virale, lo stato del flusso d’aria, le condizioni ambientali, etc. [13]. I risultati degli studi effettuati negli ospedali indicano che la ventilazione di un ambiente chiuso, gli spazi aperti, la disinfezione di ambienti e superfici, nonché delle aree dei servizi igienici, possono limitare efficacemente la concentrazione di SARS-CoV-2 nell’ambiente.
Studi su pazienti con infezioni respiratorie hanno dimostrato che, quando una persona infetta starnutisce o tossisce, si forma una nuvola di droplet cariche di agenti patogeni; queste goccioline possono viaggiare fino a 7-8 m lontano dalla sorgente [13]. L’aria espulsa con un colpo di tosse viaggia a oltre 80 km/h e trasporta fino a 3.000 droplet. Uno starnuto, invece, può arrivare ad una velocità di oltre 150 km/h e può espellere fino a 40.000 droplet infette. Come detto, non si sa ancora quante particelle virali siano necessarie per dare origine ad un contagio. Nel caso della SARS del 2002-2003, uno studio aveva stimato essere inferiore a 1.000, un numero forse maggiore rispetto a quelle necessarie nel caso del SARS-CoV-2.
Non vi è infatti accordo sulla quantità o dose virale minima capace di causare il COVID-19 in persone sane. Al contrario, molti ricercatori ritengono che poche centinaia di unità, o virioni, di SARS-CoV-2 siano sufficienti per causare il COVID-19 negli ospiti sensibili [18]. Un singolo atto respiratorio rilascia alcune centinaia di particelle, e uno studio su soggetti affetti da raffreddore ha evidenziato in questi una maggiore produzione, caratterizzata da grande variabilità: il 24% dei soggetti era responsabile dell’82% di particelle [19]. Un altro studio ha evidenziato che l’80-90% delle particelle rilasciate durante la normale respirazione sono particelle di aerosol con diametri inferiori a 1 μm [20], mentre il resto sono droplet.
Da ricordare, inoltre, anche l’esistenza dei cosiddetti “super-diffusori”, di difficilissima identificazione e che rappresentano uno dei maggiori problemi nell’espansione della pandemia di Covid-19. Diversi studi hanno infatti dimostrato che, in casi estremi, una singola persona infetta può diffondere il virus a dozzine di persone. Si ritiene difatti che alcune persone infette possano avere una carica virale più elevata e quindi rilasciare più virus, come si è visto in passato con la SARS e con la MERS. Ciò significa che è probabile che la saliva e gli aerosol di alcune persone contengano una maggiore concentrazione di particelle virali, rendendo quella persona più contagiosa [23], in accordo con quanto trovato per i rinovirus.
Una ricerca cinese pubblicata a luglio 2020 dai Centers for Disease Control and Prevention (CDC) statunitensi [21] ha mostrato come un solo paziente positivo al COVID-19 sia riuscito a infettare 9 persone all’interno di un ristorante, durante un pranzo, a causa del flusso d’aria del locale. Le 9 persone erano presenti nel suo stesso tavolo o nei tavoli vicini e si trovavano tutte sottovento – e in linea – rispetto al flusso del condizionatore d’aria in una stanza senza finestre. Gli altri 73 clienti che in quel momento si trovavano nello stesso piano del locale, invece, non si sono ammalati. Come mostra la figura qui sotto, l’aria condizionata soffiava in direzione ovest verso tre tavoli, e probabilmente ha rimbalzato contro il muro tornando verso la famiglia “C”, perché gli aerosol tendono a seguire il flusso d’aria.
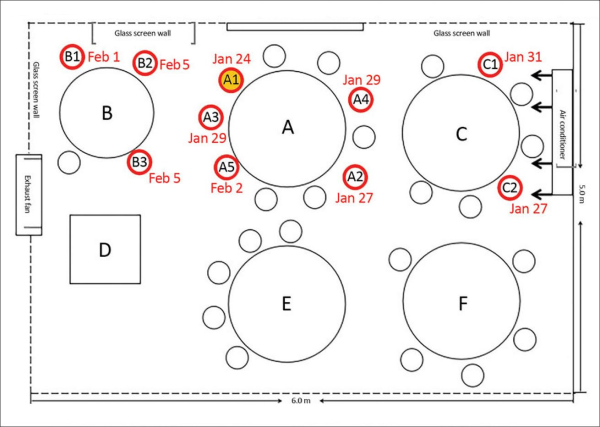 Figura 5. Lo studio cinese sul contagio associato all’aria condizionata in un ristorante [21]. Il tavolo della famiglia “A” è al centro tra i tavoli “B” e “C” dove stavano pranzando altre due famiglie, e comprende l’infetto (A1) e altre 9 persone di cui 4 si sono ammalate. La famiglia “B” e la famiglia “A” si sono incontrate per 53 minuti e tre dei suoi membri (una coppia e la figlia) si sono ammalati. La famiglia “C” sedeva accanto alla famiglia “A” nell’altro tavolo lungo lo stesso lato della stanza soggiornando con loro per 73 minuti: due dei suoi membri (una madre e sua figlia) si sono ammalati. I tavoli rotondi distavano un metro l’uno dall’altro. Sopra il tavolo della famiglia “C” c’era un apparecchio split di aria condizionata che soffiava in direzione ovest, ovvero verso sinistra nella figura, creando un flusso d’aria in quell’ala della stanza.
Figura 5. Lo studio cinese sul contagio associato all’aria condizionata in un ristorante [21]. Il tavolo della famiglia “A” è al centro tra i tavoli “B” e “C” dove stavano pranzando altre due famiglie, e comprende l’infetto (A1) e altre 9 persone di cui 4 si sono ammalate. La famiglia “B” e la famiglia “A” si sono incontrate per 53 minuti e tre dei suoi membri (una coppia e la figlia) si sono ammalati. La famiglia “C” sedeva accanto alla famiglia “A” nell’altro tavolo lungo lo stesso lato della stanza soggiornando con loro per 73 minuti: due dei suoi membri (una madre e sua figlia) si sono ammalati. I tavoli rotondi distavano un metro l’uno dall’altro. Sopra il tavolo della famiglia “C” c’era un apparecchio split di aria condizionata che soffiava in direzione ovest, ovvero verso sinistra nella figura, creando un flusso d’aria in quell’ala della stanza.
Anche uno studio su 94 casi di positività al Covid all’interno di un call center in Corea del Sud [22] – svolto grazie a un app di monitoraggio attiva in quel Paese – ha dimostrato come aumentino notevolmente i contagi se si rimane tante ore in uno stesso ambiente e sullo stesso lato della stanza, poiché la colpa è anche dei flussi d’aria, se questi si limitano a un ricircolo (come nel caso dell’aria condizionata). Al di fuori del piano del call center, invece, si sono infettate soltanto tre persone nonostante tutti i 1.145 tra dipendenti e residenti nel palazzo abbiano usato gli stessi ascensori e gli stessi spazi pubblici. Dunque, rimanere tante ore nella stessa stanza e con un flusso d’aria “sfavorevole” diventa pericoloso, per cui è fondamentale che tutti mantengano le mascherine dentro gli uffici ed è altrettanto fondamentale, laddove si può, aerare i locali di continuo per disperdere ogni possibile gocciolina rimasta in sospensione.
Uno studio pubblicato sulla rivista Proceedings of the Royal Society A [30] ha fatto emergere come parlare a lungo possa essere pericoloso tanto quanto tossire vicino ad un’altra persona, perché le micro-particelle espulse dalla bocca rimangono sospese nell’aria. Infatti, un’ora dopo che una persona contagiata ha parlato per 30 secondi, le goccioline espulse parlando, ovvero sotto forma di aerosol, contengono molta più carica virale che se si fosse emesso un colpo di tosse. Senza ventilazione, la dose virale assorbita dopo un certo tempo potrebbe essere quindi sufficiente a trasmettere il Covid. Una scoperta che può aiutare a spiegare come mai il Covid-19 si diffonde facilmente in ambienti interni – cioè al chiuso – e che dimostra come le misure di distanziamento sociale, da sole, non forniscano una protezione adeguata dal virus.
Come evidenziato da questo lavoro di modellizzazione svolto, a partire da dati sperimentali, da Oliveira et al. [30], a causa dell’elevata massa e dose virale associata alle goccioline di grandi dimensioni o droplet (circa il 99% del valore), sia un breve colpo di tosse che la prosecuzione del parlare sono pericolosi entro 2 m da un infetto senza mascherine. Mentre il ricambio d’aria tramite VMC e la conseguente ventilazione (in termini sia di ampiezza sia di direzione) è della massima importanza per la rimozione degli aerosol – e dunque per ridurre al minimo il rischio di infezione aerea al chiuso – i dispositivi di protezione individuale sono cruciali per ridurre il rischio di contaminazione a corto raggio (<2 metri), specie in presenza di sistemi di ventilazione o riciclo che inducono flussi verso l’alto oppure da un infetto verso di noi.
Come già sottolineato dall’ing. Buonanno [24], autore di lavori di ricerca e anche divulgativi sul tema (alcuni dei quali pubblicati sul sito della Fondazione Hume), “gli aerosol carichi di virus infettano i soggetti suscettibili dove sono più concentrati, con una dinamica simile al fumo di sigaretta. In ambienti con ventilazione non ottimale, gli aerosol infettivi possono accumularsi nell’aria dell’ambiente e raggiungere concentrazioni pericolose”. Le strategie mirate a contrastare la trasmissione, come il distanziamento fisico e le mascherine, sono quindi fondamentali per abbattere il rischio di trasmissione a corto raggio tramite droplet (che precipitano in pochi istanti a terra), ma per diminuire la trasmissione a medio e lungo raggio via aerosol occorre anche un’elevata ventilazione forzata con l’esterno (e/o filtrazione dell’aria).
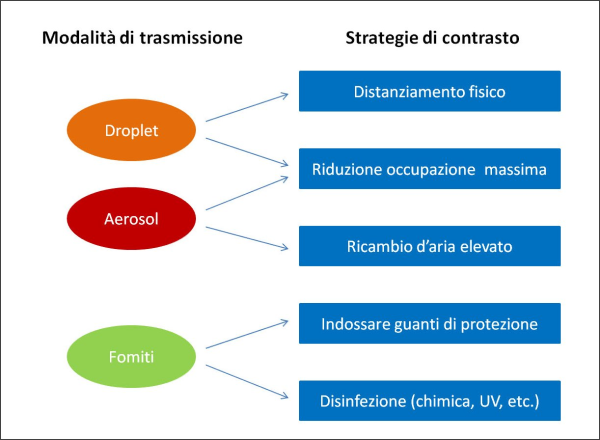 Figura 6. Schema delle strategie attuabili per contrastare la trasmissione del SARS-CoV-2. Si noti l’importanza di un ricambio d’aria elevato per proteggersi dalla trasmissione aerea del virus e come la strategia della riduzione dell’occupazione massima di un ambiente permetta di contrastare contemporaneamente sia il rischio di contagio tramite droplet sia quello di contagio tramite aerosol. (fonte elaborazione dell’Autore sulla base dei vari articoli scientifici peer reviewed citati nel testo) [24, 30].
Figura 6. Schema delle strategie attuabili per contrastare la trasmissione del SARS-CoV-2. Si noti l’importanza di un ricambio d’aria elevato per proteggersi dalla trasmissione aerea del virus e come la strategia della riduzione dell’occupazione massima di un ambiente permetta di contrastare contemporaneamente sia il rischio di contagio tramite droplet sia quello di contagio tramite aerosol. (fonte elaborazione dell’Autore sulla base dei vari articoli scientifici peer reviewed citati nel testo) [24, 30].
L’importanza delle mascherine e l’accumulo nell’aria dell’aerosol infetto
L’uso delle mascherine da parte delle persone è un buon metodo per ridurre la dose virale assorbita e dunque sia la probabilità di contagio sia la gravità della malattia sviluppata. Tuttavia, esse hanno maggiore efficacia se la compliance è elevata. Sebbene le mascherine FFP2/N95 filtrino il 95% delle particelle da 3 μm garantendo una buona protezione al personale medico che sigilla lo spazio fra viso e mascherina, l’efficacia per il grande pubblico è assai inferiore, sia perché quasi sempre non vengono indossate correttamente sia perché in Italia abbondano FFP2 “tarocche”, con capacità di filtrazione fra il 10% e il 50%. Perciò le persone che le usano sono abbastanza protette dalle goccioline infette ma non dagli aerosol infetti.
In realtà, le mascherine sono più utili se indossate dalle persone infette che non dalle persone che si vogliono proteggere, come dimostrato in modo quantitativo da un esperimento cinese di Chan J. et al. [32] svolto sui criceti. Il team di scienziati asiatici ha diviso 52 criceti in due categorie: sani e contagiati con il SARS-CoV-2. I differenti gruppi sono stati messi ciascuno all’interno di gabbie, alcune delle quali schermate da mascherine posizionate in modo da regolare i flussi d’aria degli infetti verso i sani. Dopo circa una settimana di osservazione, è emerso che il 66,7 dei criceti, quelli mancanti di protezione, avevano contratto il Covid. Di contro, il tasso di infezione è stato di poco più del 16% quando le mascherine chirurgiche sono state messe sulla gabbia degli animali infetti e di circa il 25% quando sono state collocate sulla struttura contenente i criceti sani, confermando quanto suggerito dall’intuizione.
Pertanto, la seconda ipotesi semplificativa del nostro modello di base è che tutte le persone indossino le mascherine quando si trovano in un ambiente indoor (edifici o mezzi di trasporto), mentre non prevede che si adottino i famosi 2 metri di distanziamento sociale (peraltro ben di rado osservati). Il fatto che anche mascherine male indossate o “tarocche” di pessima qualità impediscano la trasmissione del SARS-CoV-2 tramite droplet (che vengono assorbite soprattutto dalla mascherina della persona infetta che le emette), fa sì che il canale di trasmissione rimanente – dando per scontata una corretta igiene delle mani – sia quello degli aerosol, per il quale sono importanti il tempo di esposizione e la dose assorbita.
Va sottolineato che, poiché le goccioline contengono una quantità di virus proporzionale al proprio volume, mentre con quelle grandi che in breve tempo cadono a terra a poca distanza (le droplet) ci si può infettare subito se si è nel raggio di un paio di metri da un infetto privo di mascherina che parla, con quelle piccole (cioè con l’aerosol) per raggiungere la medesima dose virale minima infettante basta essere esposti (anche a vari metri di distanza) per un tempo sufficientemente più lungo. Dato che con le mascherine è attivo solo questo canale di trasmissione aerea, il nostro modello – essendo quantitativo – aiuterà anche a capire in quali luoghi/tempi si può più verosimilmente raggiungere la dose minima infettante.
Come accennato in precedenza, la norma UNI 10339 prevede una movimentazione dell’aria con velocità dell’ordine di 10 cm/sec, equivalenti a 6 metri al minuto (ad es. per una particella di aerosol). D’altra parte, se abbiamo due ricambi d’aria all’ora – come nel caso di studio illustrato in precedenza e ottemperante alla medesima norma – vuol dire che ogni minuto verrà sostituita con aria esterna al più 1/30 dell’aria presente nell’ambiente. Pertanto, l’aerosol infetto emesso in un singolo atto respiratorio da una persona infetta, in un ambiente soggetto alla norma UNI 10339 verrà gradualmente eliminato nel corso del tempo, e si può stimare che venga quasi totalmente eliminato in un tempo scala dell’ordine di mezz’ora.
Tuttavia, gli atti respiratori di una persona, in un adulto sano a riposo, sono fra i 12 ed i 16 al minuto (è bene comunque precisare che la frequenza respiratoria è legata, oltre che all’attività svolta in quel momento, anche all’età e alla frequenza cardiaca) [25]. Pertanto, come illustrato in modo assai semplice dalla figura qui sotto, quando una persona entra in un ambiente chiuso soggetto alla norma UNI 10339, la quantità di aerosol infetto aumenta gradualmente nel tempo, raggiungendo un plateau dopo circa una mezz’oretta. Se poi l’infetto abbandona l’ambiente, si verifica il fenomeno inverso, cioè dal livello di aerosol infetto raggiunto si ridiscende gradualmente fino a circa zero in una mezz’oretta.
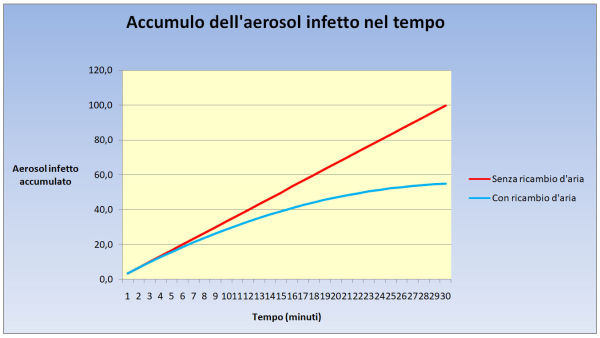 Figura 7. Come cresce la curva che esprime l’accumulo, nell’arco di mezz’ora di tempo, degli aerosol infetti emessi dai vari atti respiratori di un soggetto infetto. Come si vede, senza un ricambio d’aria (retta rossa), la crescita è lineare, mentre se c’è un ricambio d’aria ogni mezz’ora la curva (di colore azzurro) tende a un plateau sito a poco più della metà (precisamente al 55%) del valore che si ha nell’altro caso. Il primo caso, senza ricambio d’aria, è quello tipico di un’aula scolastica, mentre il secondo è quello del già citato ambiente (ad es. un call center) soggetto alla norma UNI 10339. (fonte: elaborazione dell’Autore)
Figura 7. Come cresce la curva che esprime l’accumulo, nell’arco di mezz’ora di tempo, degli aerosol infetti emessi dai vari atti respiratori di un soggetto infetto. Come si vede, senza un ricambio d’aria (retta rossa), la crescita è lineare, mentre se c’è un ricambio d’aria ogni mezz’ora la curva (di colore azzurro) tende a un plateau sito a poco più della metà (precisamente al 55%) del valore che si ha nell’altro caso. Il primo caso, senza ricambio d’aria, è quello tipico di un’aula scolastica, mentre il secondo è quello del già citato ambiente (ad es. un call center) soggetto alla norma UNI 10339. (fonte: elaborazione dell’Autore)
Noi inspiriamo ogni ora circa 600 litri d’aria (e durante l’attività sportiva oltre 5 volte di più), pari a 10 litri al minuto [26]. Poiché in una tipica aula di scuola di 137 mc vi sono 300.000 litri d’aria, se ad es. nella classe vi sono 26 studenti l’aria totale da essi respirata fra un cambio d’aria orario e l’altro è di 300 litri x 26 = 7.800 litri, pari al 2,6% dell’aria totale ivi presente. Oltre all’accumulo di aerosol infetto (se è presente un infetto), si assiste quindi, parallelamente, anche ad un accumulo di anidride carbonica (CO2) – misurabile anche con un monitor low cost – rispetto al valore di fondo atmosferico di 400 ppm (parti per milione). Pertanto, si potrebbe in teoria usare a posteriori il livello di CO2 misurato per una precisa calibrazione del ns. modello.
Infatti, solo circa lo 0,04% dell’aria inspirata è anidride carbonica (CO2), mentre nell’aria espirata dai nostri polmoni la percentuale di CO2 aumenta al 4% [26]. Dunque, nell’esempio appena fatto, inizialmente nell’aula sono presenti lo 0,04% di 300.000 litri d’aria, ovvero 120 litri, di CO2. Ma i 26 studenti in un’ora emetteranno il 4% di 7800 litri, ovvero 312 litri, di CO2. Pertanto, dopo un’ora nell’aula il livello di CO2 sarà salito a 120 + 312 = 432 litri, ovvero a 432 / 120 = 3,6 volte il livello iniziale, e dunque a 3,6 x 360 = 1.296 ppm. Quando si supera 1.500 ppm, si inizia ad avvertire il disagio di respirare “aria viziata” [27]. Anche in casa i livelli di CO2 possono variare tanto, ed essere compresi fra 500 e 2.000 ppm (di notte).
Secondo lo studio di De Oliveira et al. [30], l’aerosol sospeso emesso parlando ininterrottamente per 1 ora in una stanza scarsamente ventilata fornisce lo 0,1-11% di rischio di infezione per le cariche virali iniziali di 108-1010 virioni/ml, rispettivamente; diminuendo allo 0,03-3% per 10 ricambi d’aria all’ora tramite la ventilazione forzata con l’esterno. Questi risultati forniscono stime quantitative utili per lo sviluppo del distanziamento fisico e di una Ventilazione Meccanica Controllata efficace. La misurazione dei livelli di CO2 in un ambiente può essere usata come facile e utile indicatore indiretto del livello di ricambio d’aria attuale (baseline) e per un confronto con i valori di CO2 attesi se viene rispettata la norma UNI 10339 (non è infatti difficile realizzare un algoritmo che consente di fare questo calcolo – tenendo conto naturalmente del tipo di attività svolta delle persone – per un confronto con i valori effettivamente misurati).
Il modello implementato nel calcolatore di dose virale assorbita
A questo punto, capito anche quantitativamente il fenomeno, risulta molto facile implementare il modello, cosa che faremo tramite un “calcolatore di dose virale assorbita” realizzato con un foglio di calcolo Excel, di cui la Tabella 1 qui sotto mostra il pannello con i parametri generali da fornire in ingresso. Dato che non ci interessa la dose virale assoluta – bensì solo quella relativa – per poter confrontare tra loro i vari Punti di Interesse (POI), ne consegue che in realtà i valori di questi parametri generali (caselle verdi) non sono decisivi. In pratica, anche se ad es. li raddoppiassi, la graduatoria finale dei POI per dose assorbita non cambierebbe affatto; ad ogni modo, ho adottato valori realistici.
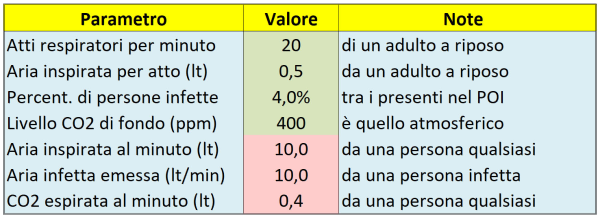 Tabella 1. Alcuni parametri generali, già illustrati nel testo, da fornire in ingresso (caselle verdi) al calcolatore di dose virale assorbita e primi semplici risultati dei calcoli (caselle rosse).
Tabella 1. Alcuni parametri generali, già illustrati nel testo, da fornire in ingresso (caselle verdi) al calcolatore di dose virale assorbita e primi semplici risultati dei calcoli (caselle rosse).
Un’altra conseguenza del fatto che non ci interessano i valori assoluti ma solo quelli relativi è che, per quanto riguarda la dose di aria infetta assorbita da una persona nei vari ambienti (POI) considerati, non occorre ragionare in termini “particellari” (cioè da fisici) bensì si può considerare infetta tutta l’aria espirata da una persona contagiosa, misurata in litri/minuto. Questo è un approccio più pratico, che ci semplifica non poco la vita senza però alterare il risultato finale (la suddetta graduatoria finale dei POI per dose assorbita). Insomma, è un po’ come se alla fine di un’escursione di trekking dicessimo: “oggi mi sono bevuto 1 litro di acqua”, anziché dire “oggi mi sono bevuto 3,3 x 1025 molecole di H2O”.
A questo punto possiamo passare a illustrare la Tabella 2, che è la parte principale del nostro calcolatore di dose virale assorbita. La parte sopra e la parte sotto della Tabella 2 vanno immaginate come poste su un’unica riga del foglio di calcolo Excel; qui sono riportate staccate solo perché altrimenti la figura risulterebbe troppo larga e quindi illeggibile. Anche qui nelle caselle verdi vengono immessi i valori di vari parametri rilevanti al problema: lunghezza, larghezza e altezza di un ambiente (ipotizzato avere la forma di un parallelepipedo); numero di persone che lo occupano; tempo di permanenza di queste persone nell’ambiente (dunque equivalente al tempo di esposizione, se è presente almeno 1 infetto).
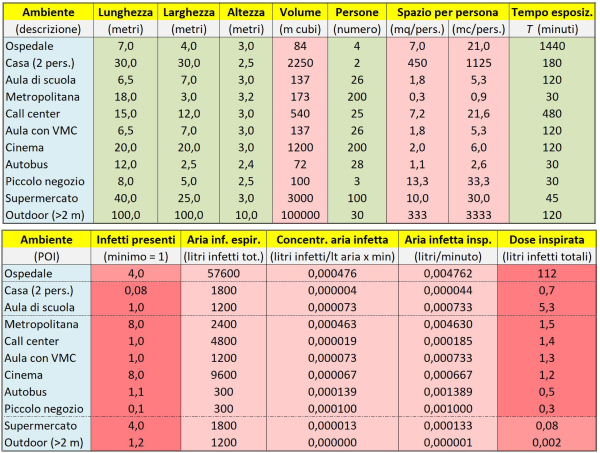 Tabella 2. Il calcolatore di dose virale assorbita che ho sviluppato per confrontare il rischio di contagio da SARS-CoV-2 in vari comuni luoghi frequentati dalle persone. La parte alta e quella bassa della figura vanno immaginate allineate in un’unica lunga tabella. Al solito, le caselle verdi rappresentano dati in ingresso e quelle rosse dati in uscita, ovvero frutto di calcoli.
Tabella 2. Il calcolatore di dose virale assorbita che ho sviluppato per confrontare il rischio di contagio da SARS-CoV-2 in vari comuni luoghi frequentati dalle persone. La parte alta e quella bassa della figura vanno immaginate allineate in un’unica lunga tabella. Al solito, le caselle verdi rappresentano dati in ingresso e quelle rosse dati in uscita, ovvero frutto di calcoli.
Come risultato di semplicissimi calcoli, otteniamo in altre colonne della tabella: il volume (in metri cubi) dell’ambiente; il volume e lo spazio medio a disposizione per ogni persona (per il confronto con i requisiti di legge); il numero di infetti presenti. Quest’ultimo viene stimato grazie alla percentuale di persone infette fra quelle presenti nel POI, un parametro immesso nella Tabella 1. Qui ho adottato una percentuale del 4%, come in prossimità del picco della terza ondata di Covid in Italia nel marzo 2021. Se dunque un “marziano” fosse arrivato all’epoca in uno dei POI italiani, avrebbe trovato – a parità di altre condizioni! – in media più infetti presenti in un luogo affollato (ad es. metropolitana, cinema, etc.) che in uno poco affollato.
Proprio per tener conto del fatto che nei luoghi affollati si possono trovare più infetti – e quindi si può avere per i sani una dose virale assorbita maggiore – i calcoli nelle colonne successive sono stati effettuati considerando sempre presente nell’ambiente preso in esame almeno 1 persona infetta (dato che un valore inferiore a 1 non avrebbe evidentemente alcun senso se si ragiona, come stiamo facendo, sul singolo POI), salvo che nel caso della metropolitana (dove adottiamo il numero trovato di 8,0 infetti), del cinema (8,0 infetti) e del supermercato (4,0 infetti). Ciò per rendere il più possibile omogeneo e sensato il confronto fra i vari POI. Ma si noti che, se raddoppiassimo il parametro “percentuale di persone infette”, la graduatoria finale dei POI, al solito, non cambierebbe.
La colonna successiva della Tabella 2, quella relativa all’“aria infetta espirata”, è dunque data dal prodotto fra l’aria emessa da una persona contagiosa (10 litri al minuto, come da Tabella 1) per il numero di minuti in cui questa è presente nell’ambiente (si ipotizza che l’infetto entri nell’ambiente al tempo t = 0, cioè possiamo immaginare che entri contemporaneamente a noi). Le due colonne successive, “concentrazione dell’aria infetta” e “aria infetta inspirata”, hanno semplicemente lo scopo di calcolare la quantità di aria infetta respirata da una persona sana presente nell’ambiente, che dipende dalla sua concentrazione, che a sua volta è inversamente proporzionale al volume dell’ambiente in metri cubi.
Infine, l’ultima colonna calcola la dose virale totale inspirata da una persona che permane nel POI per il tempo considerato come realistico per ciascun POI. Calcolare questa dose equivale, dal punto di vista matematico, a calcolare – con riferimento alla Fig. 7 illustrata in precedenza – l’area sotto la retta rossa per i POI senza ricambio d’aria continuo (casa e aula di scuola) e, invece, l’area sotto la curva azzurra per tutti gli altri POI. Si noti che, dopo mezz’ora (quando cioè viene raggiunto il plateau), l’area sotto la curva azzurra è pari al 74% dell’area sotto la retta rossa. Dunque, la dose virale assorbita in assenza di ricambio d’aria è (a parità di altre condizioni) maggiore e il divario cresce molto di più nei minuti successivi al plateau.
Le prime stime relative ottenute e un piccolo raffinamento del modello
In realtà, anche se all’apparenza abbiamo finito, nel modello occorre tener conto di alcuni aspetti ulteriori, che ho riportato nella Tabella 3 qui sotto forma di tre colonne azzurre con dei fattori moltiplicativi. La prima colonna (“No mask”) serve a tenere conto del fatto che, a casa, non si indossano mascherine, per cui la dose viene assorbita verosimilmente soprattutto attraverso le droplet, che hanno un volume notevole; pertanto, si deve considerare una dose realistica di almeno 10 volte maggiore rispetto a quella stimata sotto l’ipotesi semplificativa (valida per gli altri POI) che tutti indossino le mascherine. Si noti che le mascherine FFP2, se ben indossate, assorbono il 95% delle particelle, giustificando il fattore 10 introdotto per la differenza fra l’assenza di mascherine e l’uso sia da parte degli infetti che dei sani.
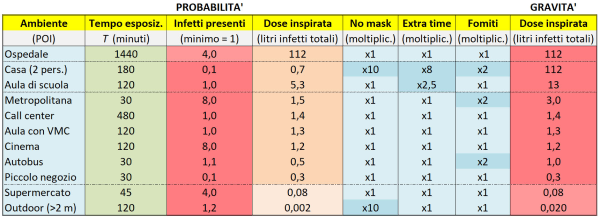 Tabella 3. Alcuni possibili raffinamenti del calcolatore di dose assorbita, implementati sotto forma di fattori correttivi moltiplicativi, come illustrato nel testo. Si noti come l’unico fattore correttivo realmente importante (in quanto è l’unico che altera la graduatoria del rischio nei vari luoghi, o POI, considerati) risulti essere rappresentato dalle mascherine, la cui importanza è sottolineata anche nel seguito di questo articolo.
Tabella 3. Alcuni possibili raffinamenti del calcolatore di dose assorbita, implementati sotto forma di fattori correttivi moltiplicativi, come illustrato nel testo. Si noti come l’unico fattore correttivo realmente importante (in quanto è l’unico che altera la graduatoria del rischio nei vari luoghi, o POI, considerati) risulti essere rappresentato dalle mascherine, la cui importanza è sottolineata anche nel seguito di questo articolo.
La terza colonna azzurra (“Fomiti”) tiene conto del fatto che in ben tre POI (casa, metropolitana e autobus) fra quelli considerati e, più in generale, sui mezzi di trasporto il canale di trasmissione attraverso il contatto con superfici infette (perché vi si sono depositate delle goccioline) non è necessariamente trascurabile, sebbene in questo caso non sia ovvio quale fattore moltiplicativo minimo si dovrebbe adottare (ho scelto perciò, alquanto arbitrariamente, un fattore 2, il più piccolo possibile). Infine, la seconda colonna azzurra (“Extra time”) tiene conto del fatto che, in casa e in un’aula di scuola, si sta più dei 180 minuti di tempo considerati dal calcolatore. Ma allora perché non si è messo direttamente il tempo giusto?
Si tratta di un aspetto alquanto più difficile da spiegare in un articolo divulgativo, ma ci proverò. Nel nostro modello, vi sono essenzialmente tre diversi tempi-scala: i 3 secondi fra un atto respiratorio e un altro di qualsiasi persona (sana o infetta); i 30 minuti che caratterizzano un ricambio d’aria (teoricamente) completo negli ambienti chiusi soggetti alla norma UNI 10339; i 180 minuti (3 ore) legati al decadimento esponenziale del numero di particelle infettanti nell’aria presente nell’ambiente considerato [30, 31]. Mentre negli ambienti chiusi soggetti alla norma UNI 10339 le particelle infettanti non permangono nell’aria così a lungo perché dopo mezz’ora ho – se la norma è rispettata – un ricambio d’aria completo, negli altri Punti di Interesse (POI) sì, e occorre tenerne conto.
Pertanto, per stimare la dose virale totale assorbita negli ambienti chiusi tenendo conto del fatto che comunque entro 180 minuti le particelle non sono più infettanti, occorre procedere in due step: (1) dapprima occorre calcolare la dose virale assorbita in 180 minuti e poi (2) occorre moltiplicare tale valore per un fattore correttivo, in modo da tener conto di eventuali minuti di permanenza nell’ambiente oltre i 180 già considerati. Si noti, comunque, che anche se NON si usassero i fattori correttivi delle ultime due colonne azzurre, la graduatoria finale dei POI per dose assorbita NON cambierebbe affatto! Dunque, di fatto, l’unico fattore correttivo davvero importante (ai fini della graduatoria) è quello “no mask”.
Perciò, come a questo punto dovrebbe risultare chiaro al lettore, i valori da inserire nel calcolatore di dose che occorre scegliere con cura sono quelli che si riferiscono ai singoli POI considerati: dimensioni fisiche dell’ambiente e occupazione massima consentita. Per tale motivo, i valori adottati nelle tabelle mostrate sono frutto di alcune ricerche di informazioni specifiche, così da adattare al meglio il calcolatore alla realtà italiana. Per esempio, il D.M. 18/12/1975 prevede che le aule scolastiche siano di altezza non minore a 3 metri e che la superficie per alunno sia di 1,80 mq/alunno nelle scuole materne, elementari, medie e 1,96 mq/alunno nelle scuole superiori [33]. Quindi, in una classe con 25 alunni, essendo l’indice minimo per alunno di 1,80 mq, la superficie minima necessaria dovrebbe essere di almeno 45 mq. Pertanto, nel nostro calcolatore abbiamo ipotizzato una superficie di 45,5 mq e la presenza di 26 alunni.
Nel caso della metropolitana, invece, da una fonte considerata attendibile [34] sappiamo che le vetture hanno mediamente le seguenti dimensioni: larghezza 2,4-3,1 metri; lunghezza 15-20 metri; altezza 3-3,6 metri. Mentre la capacità di trasporto di una singola vettura è di 100-200 passeggeri. Pertanto, nel nostro calcolatore abbiamo ipotizzato una lunghezza di 18 metri, una larghezza di 3 metri e un’altezza di 3,2 metri, con una presenza di 200 persone. Nel caso degli ospedali, invece, si è considerata una camera con 4 malati Covid, ma non appartenente a un reparto di malattie infettive. Questi ultimi, infatti, sono di solito soggetti ad elevato ricambio d’aria ed a pressione dell’aria negativa (almeno nei migliori ospedali, nei peggiori solo alcune camere sono a pressione negativa), per cui in generale rappresentano un caso a sé.
A questo proposito, è interessante notare come a volte dei risultati che sembrano essere, diciamo, tecnicamente “dubbi” siano accettati dai media senza alcuno spirito critico. In una ricerca – di cui il prof. Bassetti parlò in un’intervista [35] – effettuata all’Ospedale San Martino di Genova (e realizzata con l’ausilio di un gorgogliatore per trasferire in acqua l’aria contenente l’aerosol di un malato Covid presente nella stanza) non è stata rilevata – secondo il pezzo giornalistico – la presenza del virus. Ciò, però, non stupisce affatto, poiché qualsiasi esperto di fisica-chimica sa che non è pensabile di estrarre dall’aria particelle così piccole usando un semplice gorgogliatore (se fosse così facile, avremmo risolto il problema dell’inquinamento da particolato in ambiente indoor!), bensì bisogna usare sistemi ben più complessi (come peraltro vedremo fra poco). In altre parole, probabilmente a Genova non hanno trovato nulla nell’acqua del gorgogliatore solo perché hanno misurato… “il nulla”!
Ciò non toglie, comunque, che negli ospedali con un buon ricambio d’aria la presenza del virus sia più contenuta. La cosa è stata confermata anche da una ricerca dell’ARPA Piemonte svolta in collaborazione con il Laboratorio di virologia molecolare e ricerca antivirale del Polo universitario San Luigi Gonzaga di Orbassano i cui risultati, già anticipati a gennaio dai media [72], sono stati pubblicati in questi giorni [73]. Lo studio in questione ha confermato una minore presenza del virus negli ospedali e nei luoghi al chiuso dove il sistema di areazione funziona alla perfezione. I reparti di terapia intensiva, nonostante la presenza di pazienti con Covid-19, sono risultati essere quelli dove il virus circola meno nell’aria. Nelle abitazioni private, al contrario, le concentrazioni di SARS-Cov-2 si sono rivelate più consistenti: fino a 40-50 copie genomiche del virus per metro cubo di aria; e tali valori risultano fortemente influenzabili dalle frequenze di ricambio d’aria e dal numero di soggetti positivi presenti nelle abitazioni, oltreché dallo sviluppo dei sintomi più comuni della malattia (tra cui principalmente la tosse secca).
Le ricerche, svolte a campione sul territorio piemontese, hanno analizzato le emissioni nell’aria del virus SARS Cov-2 da parte di pazienti con una carica virale nota. Le persone contagiate si sono esercitate a respirare, parlare o leggere a una distanza di un metro e mezzo da un apparecchio di rilevazione. L’esperimento ha evidenziato che il virus si può diffondere nell’aria, tramite le goccioline di saliva, le secrezioni respiratorie e salivari ben oltre lo spazio di sicurezza indicato dagli esperti. Per il campionamento del virus non sono stati usati metodi semplicistici, bensì: un impattatore centrifugo in grado di accelerare il flusso d’aria aspirato alla velocità del suono, minimizzare le perdite per evaporazione, mantenere l’infettività e l’integrità delle particelle virali trasferendole direttamente in una soluzione di trasporto adeguata; un campionatore a basso volume per la filtrazione dell’aria su filtri in PTFE, materiale che garantisce la massima capacità di cattura delle particelle virali di dimensioni comprese tra 10 e 900 nanometri; un campionatore ad alto volume per la filtrazione dell’aria su filtri in fibra di vetro o quarzo, in grado di aspirare l’intero volume di una stanza in meno di un’ora.
Analisi dei risultati ottenuti: cosa abbiamo imparato ai fini del controllo della pandemia?
Se si va ad analizzare la graduatoria finale dei POI per dose virale assorbita, si vede che nettamente ai primi due posti si trovano la casa (in quanto lì non si usano le mascherine) e l’ospedale (in quanto vi è un’alta densità di infetti Covid, spesso anche quando fuori di esso il numero è basso), in perfetto accordo con quanto trovato dal rapporto dell’ISS e da quello dell’Istat citati all’inizio di questo articolo; ma va ricordato che, se nell’ospedale c’è un tasso di ricambio d’aria elevato, il virus circola meno. La dose virale assorbita in un’aula scolastica o in qualsiasi altro POI – mezzi di trasporti compresi – risulta essere oltre 10 volte più bassa, il che spiega molto bene non solo perché a casa o in ospedale una persona sana si contagi più facilmente, ma anche perché spesso le conseguenze su intere famiglie siano letali. In questi ambienti, si ha infatti il cosiddetto “reinoculo” del virus, che ne facilita il prevalere sul sistema immunitario.
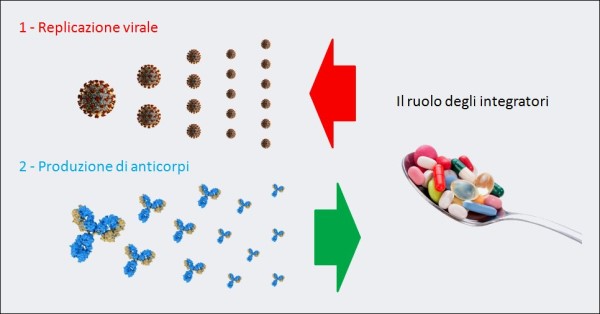
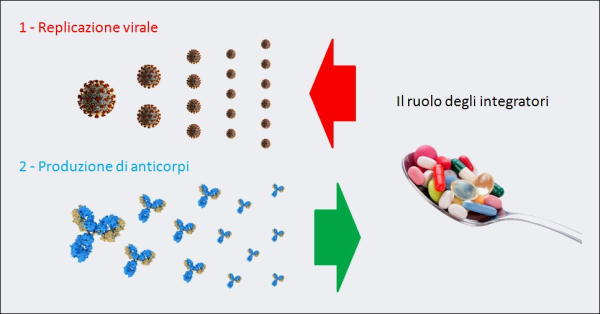 Figura 8. La “guerra” di un organismo contro il COVID-19 è, inizialmente, una battaglia fra la replicazione virale del SARS-CoV-2 e la produzione di anticorpi neutralizzanti queste particelle virali. Per questo alcuni integratori (ad es. vitamina D, lattoferrina, etc.), grazie alla loro azione antivirale e immunomodulante, se presi quotidianamente come forma di prevenzione della progressione della malattia verso stadi più gravi, in caso di contagio rallentano la moltiplicazione delle particelle di virus e aiutano le difese immunitarie. Invece, il reinoculo del virus – ad es. attraverso l’aria – va esattamente nella direzione opposta: facilita la “vittoria” della replicazione virale, esponendo le persone a un maggior rischio di esito infausto.
Figura 8. La “guerra” di un organismo contro il COVID-19 è, inizialmente, una battaglia fra la replicazione virale del SARS-CoV-2 e la produzione di anticorpi neutralizzanti queste particelle virali. Per questo alcuni integratori (ad es. vitamina D, lattoferrina, etc.), grazie alla loro azione antivirale e immunomodulante, se presi quotidianamente come forma di prevenzione della progressione della malattia verso stadi più gravi, in caso di contagio rallentano la moltiplicazione delle particelle di virus e aiutano le difese immunitarie. Invece, il reinoculo del virus – ad es. attraverso l’aria – va esattamente nella direzione opposta: facilita la “vittoria” della replicazione virale, esponendo le persone a un maggior rischio di esito infausto.
La dose virale assorbita in un’aula di scuola, tuttavia, risulta a sua volta circa 10 volte maggiore dei POI che la seguono in graduatoria, eccezion fatta per la metropolitana. In altre parole, è una dose piuttosto elevata a causa dell’assenza di ricambio d’aria continuo. Donde la necessità di avere, in ogni aula scolastica, un sistema di Ventilazione Meccanica Controllata (VMC), non solo per ovvi motivi di prevenzione del contagio (come si vede dalla tabella, in un’aula con VMC si ha una dose assorbita almeno 10 volte inferiore), ma anche per il benessere di tutti gli occupanti, essendo la concentrazione di CO2 che si raggiunge dopo 2 ore superiore a quella tollerabile (si veda l’ultima figura di questo articolo relativa a soli 45 minuti di misurazione della CO2 in un’aula scolastica), con ripercussioni anche sulle prestazioni cognitive [42].
Si noti che, quando in questo articolo si parla di ricambio d’aria, si intende sempre che esso sia fatto tramite una circolazione dell’aria con l’esterno (outdoor). Infatti, il semplice ricircolo dell’aria, quand’anche con filtraggio della stessa effettuato con filtri HEPA o altri filtri economici, purtroppo non garantisce affatto l’eliminazione del virus dall’aria, in quanto questi filtri sono fatti per fermare particelle superiori a 0,3 µm, come quelle che creano problemi alle persone allergiche. Inoltre, mi è capitato di testare dei purificatori d’aria che abbattevano il particolato in una stanza, mentre altri della stessa marca e modello no, in quanto il filtro non era aderente. Insomma, con la Ventilazione Meccanica Controllata si va sul sicuro, mentre il semplice ricircolo e filtraggio dell’aria lo sconsiglio decisamente. Eppure, i treni italiani ad alta velocità si vantano nella pubblicità di filtrare l’aria, anziché – come dovrebbero – di cambiarla spesso!
In mancanza di Ventilazione Meccanica Controllata, l’aerazione degli edifici scolastici è dunque uno dei migliori modi per ridurre la diffusione del virus. Infatti, un recente studio [49] ha stimato che le finestre aperte nelle aule possono ridurre fino a 14 volte la trasmissione del virus. L’apertura delle finestre in inverno ha addirittura un impatto doppio rispetto all’apertura durante l’estate. Tuttavia, considerato il dispendio energetico aggiuntivo che si ha in questo modo, facendo due conti si scopre che con la spesa per il combustibile (quest’anno peraltro ancora più caro) ci si sarebbe potuto pagare una buona quota dell’impianto VMC, che per il resto si sarebbe ripagato da solo in 2-3 anni grazie al risparmio energetico che garantisce. Naturalmente, per le scuole si sarebbe potuto lavorare anche sui turni scolastici, sugli scaglionamenti di orari, etc. per ridurre – al tempo stesso – l’occupazione massima effettiva delle aule.
La metropolitana, invece, presenta nel mio calcolatore una dose assorbita teorica relativamente bassa rispetto a quanto forse ci si sarebbe potuto attendere, tuttavia vanno sottolineati due aspetti molto importanti che chiariscono la situazione reale. Il primo è che nelle tratte sotterranee delle metropolitane italiane il livello di particolato (PM10 e PM2.5) è fra i più alti se confrontato con altre metro di tutto il mondo, Cina compresa: fino a 5 volte i limiti di legge che esistono per l’esterno [36]; ora, proprio il particolato può essere, secondo un’idea proposta dai ricercatori Setti et al. [37], un possibile vettore virale (almeno per gli ambienti indoor, poiché outdoor si è trovato meno di 1 virione per particella di PM10 in ciascuno dei 12 intervalli di diametro esaminati, dalle nanoparticelle fino a quelle più grandi [39]), per cui la dose virale assorbita fornita dal nostro calcolatore potrebbe essere – per le metro italiane – alquanto sottostimata (più realistica, invece, appare la dose assorbita ottenuta per gli autobus).
Secondo aspetto: vi è una differenza fondamentale fra la metropolitana ed i due precedenti POI rilevanti (casa ed aula di scuola). Ogni persona frequenta, nella vita quotidiana, una ristretta cerchia di persone – che sono, quindi, sempre le stesse – eccetto che quando si reca sui mezzi di trasporto oppure in cinema, negozi, supermercati, etc. Dunque, è verosimile che il ruolo principale della metropolitana nel diffondere i contagi non sia tanto nel numero di contagi che vi avvengono a bordo (che, come visto, potrebbe non essere così elevato), quanto per il fatto che quei “pochi” contagi mettono in contatto cerchie in cui il virus era presente con cerchie in cui non lo era ancora, con il risultato di accelerarne di molto la diffusione (il che spiega anche perché la curva di crescita dei contagi, in Italia, è assai più ripida nelle Province con una metropolitana). Del resto, è noto dalla letteratura [65] che il trasporto pubblico (treni, autobus ed aerei) è importante nella diffusione del virus, specie quando si tratta di trasporti a lunga distanza.
 Figura 9. Le metropolitane hanno un forte effetto moltiplicatore nella diffusione dell’epidemia di SARS-CoV-2, poiché in poco tempo mettono in contatto il virus con un gran numero di cerchie di persone diverse, molte delle quali in precedenza “vergini” e collocate in località periferiche o di provincia. È un po’ come se, appiccato il fuoco in un punto del bosco, il vento spargesse dei tizzoni ardenti in giro ed a grande distanza, per cui il fuoco divampa poi parallelamente in vari punti, bruciando più rapidamente il bosco. Nella figura qui mostrata (o grafo), i punti neri rappresentano le persone infette, i punti rosa quelle con malattia in incubazione (e quindi non contagiose), mentre i punti verdi rappresentano le persone sane.
Figura 9. Le metropolitane hanno un forte effetto moltiplicatore nella diffusione dell’epidemia di SARS-CoV-2, poiché in poco tempo mettono in contatto il virus con un gran numero di cerchie di persone diverse, molte delle quali in precedenza “vergini” e collocate in località periferiche o di provincia. È un po’ come se, appiccato il fuoco in un punto del bosco, il vento spargesse dei tizzoni ardenti in giro ed a grande distanza, per cui il fuoco divampa poi parallelamente in vari punti, bruciando più rapidamente il bosco. Nella figura qui mostrata (o grafo), i punti neri rappresentano le persone infette, i punti rosa quelle con malattia in incubazione (e quindi non contagiose), mentre i punti verdi rappresentano le persone sane.
L’importanza del trasporto pubblico nella diffusione dell’epidemia di Covid è confermata dalla letteratura scientifica. Come scoperto dagli studiosi del Centro per la pianificazione urbana dello Zhejiang, in Cina, che hanno di recente pubblicato i risultati del loro lavoro relativo a 30 città europee (fra cui Milano, Torino e Genova) [76], vi sono aspetti che agevolerebbero la violenta diffusione del contagio in determinate città (come ad es. Milano, dove più del 40% degli spostamenti avviene mediante il trasporto pubblico) a discapito di altre. La diversità riscontrata nelle caratteristiche urbane è infatti risultata in larga misura correlata alla loro vulnerabilità: in pratica, al numero di infezioni registrate. La connettività intracity (cioè nell’ambito urbano e interurbano) attraverso il trasporto pubblico è risultata essere il possibile fattore principale di tale vulnerabilità, seguita dalla dimensione della popolazione, dalla densità e dalla connettività intercity, cioè fra città. Anche la morfologia urbana sembra contribuire all’epidemia: sia le città radiali che quelle a griglia sono associate a tassi di infezione più elevati rispetto alle città lineari. E sappiamo da altri studi che, durante i primi mesi della pandemia, l’utilizzo dei suddetti mezzi di trasporto è stato uno dei fattori che più ha inciso sulla diffusione del coronavirus: non tanto perché sia più facile infettarsi al loro interno, ma proprio per l’incessante movimento di ingenti quantità di persone.
Un discorso simile (quello cioè del mettere in contatto persone di cerchie diverse) non si applica invece al call center, né ad altri uffici (purché, naturalmente, abbiano un ricambio d’aria che rispetta la norma di legge, cosa non sempre così scontata, donde la necessità di verifiche a campione); mentre si applica senza dubbio al cinema, al piccolo negozio, al supermercato, etc., dove la maggior parte dei presenti sono evidentemente sconosciuti. Per tale motivo, il ridurre in questi luoghi l’occupazione massima consentita appare una buona misura – come suggerito dallo studio USA citato in precedenza – e, soprattutto quando l’impatto economico della pandemia è rilevante (come nel caso italiano per il lockdown prima [9] e ora per il Green Pass, che restringe gli accessi a molti luoghi), dovrebbe essere senz’altro preferito alla riduzione della mobilità delle persone. Per ragioni analoghe, si dovrebbero aumentare le corse delle metro e ridurne l’occupazione massima a favore di mezzi di superficie (bus, tram, etc.).
Si noti che, in Italia, si è andati invece addirittura nella direzione opposta, poiché con il coprifuoco praticato nel periodo più critico della pandemia si è spinto al massimo il tasso di occupazione delle metro nelle fasce orarie serali, dato che le persone dopo cena dovevano rincasare presto per poter evitare la multa. Inoltre so da amici che, con la chiusura nelle scuole, in Lombardia (e probabilmente anche altrove) si è passati per gli autobus all’orario estivo, con forte riduzione del numero di corse. Tutto ciò dimostra come la questione dei trasporti sia stata gestita non meno peggio di quella della scuola. Per non parlare delle mascherine, di cui nessuno spot del Ministero della Salute ha mostrato l’uso corretto. Insomma, il lockdown poteva essere in gran parte evitato anche da noi, se solo i Ministeri avessero dato le direttive giuste anche in relazione a numerosi altri aspetti che non sono oggetto del presente articolo (vedi [69] e [63]), ed averlo usato è stato un po’ come distruggere un alveare di vespe su una casa usando un cannone: le vespe così le elimini, d’accordo; ma distruggi mezza casa, ovvero nel nostro caso il tessuto economico.
La nostra Tabella 3 mostra, infine, come quello del contagio outdoor sia un problema trascurabile (con una dose assorbita circa 50 volte inferiore) rispetto a quello indoor, a conferma di una meta-analisi [38] che ha trovato la probabilità di trasmissione indoor circa 20 volte maggiore rispetto a quella outdoor, per cui all’aperto si può stare senza mascherina senza correre rischi particolari, se si sta a qualche metro da altri (ma il Governo italiano, anche in questo caso, è andato proprio nella direzione opposta!). Infine, l’elevato rischio che si corre con i contagi in ambito domestico per via del reinoculo imporrebbe l’uso di Covid hotel, che sono stati assai utilizzati in Cina ma non da noi. Se quindi siamo stati uno dei Paesi con più alta mortalità da Covid del mondo, beh credo di avere fornito una serie abbastanza lunga di possibili ragioni…
 Tabella 4. Le misure adottate in Italia nei vari luoghi e quelle che sarebbero state corrette alla luce di quanto abbiamo imparato in questo articolo. Si noti che il lockdown può ottenere un effetto almeno pari alle misure qui suggerite per quanto riguarda la riduzione delle ospedalizzazioni, ma con un impatto sul tessuto economico e sociale enorme, pertanto non può essere impiegato che per pochi giorni. Risulta evidente, quindi, come la strategia attuata dal Governo italiano sia stata poco equilibrata (eccetto che per bar, ristoranti e palestre, dove per l’impossibilità di usare la mascherina qualche restrizione in più era doverosa), puntando troppo su riduzione totale (con il lockdown) o parziale (con il Green Pass) della mobilità e chiusure di attività, attuandole peraltro con tempistiche sbagliate e, soprattutto, senza una visione globale ed a lungo termine del problema. Altrettanto poco logiche appaiono le multe fatte a persone ed attività, relative al rispetto delle misure della colonna rossa e non per imporre le misure, dal punto di vista dell’interesse generale del Paese ben più raccomandabili, della colonna verde, fermo restando che si sarebbe potuto convincere le persone usando anche altre “armi”: spot informativi, meccanismi premianti, etc.
Tabella 4. Le misure adottate in Italia nei vari luoghi e quelle che sarebbero state corrette alla luce di quanto abbiamo imparato in questo articolo. Si noti che il lockdown può ottenere un effetto almeno pari alle misure qui suggerite per quanto riguarda la riduzione delle ospedalizzazioni, ma con un impatto sul tessuto economico e sociale enorme, pertanto non può essere impiegato che per pochi giorni. Risulta evidente, quindi, come la strategia attuata dal Governo italiano sia stata poco equilibrata (eccetto che per bar, ristoranti e palestre, dove per l’impossibilità di usare la mascherina qualche restrizione in più era doverosa), puntando troppo su riduzione totale (con il lockdown) o parziale (con il Green Pass) della mobilità e chiusure di attività, attuandole peraltro con tempistiche sbagliate e, soprattutto, senza una visione globale ed a lungo termine del problema. Altrettanto poco logiche appaiono le multe fatte a persone ed attività, relative al rispetto delle misure della colonna rossa e non per imporre le misure, dal punto di vista dell’interesse generale del Paese ben più raccomandabili, della colonna verde, fermo restando che si sarebbe potuto convincere le persone usando anche altre “armi”: spot informativi, meccanismi premianti, etc.
In conclusione, il simulatore di dose virale assorbita da me sviluppato e illustrato in questo articolo non solo conferma quanto trovato dai rapporti dell’ISS e dell’Istat – e cioè il fatto che il contesto familiare / domiciliare e quello sanitario / assistenziale sono quelli di gran lunga più a rischio di contagio – ma in più: (1) permette di capire come essi siano anche i contesti più a rischio di forme gravi della malattia, poiché vi è associata una dose virale assorbita assai maggiore rispetto a tutti gli altri luoghi considerati nella mia analisi; (2) permette di stimare, comparativamente, il rischio di contagio (e di potenziale gravità della malattia sviluppata) in luoghi come i trasporti, la scuola, etc. non considerati dai citati rapporti ISS e Istat; (3) l’algoritmo da me messo a punto può essere facilmente esteso per la stima del rischio di contagio in altri luoghi specifici, e quindi rappresenta una buona base di partenza per studi più raffinati e dettagliati.
Due misure sottovalutate: il contact tracing digitale e la verifica del tasso di ricambio d’aria
Come mi è stato fatto notare dal dr. Giuseppe Imbalzano, già Direttore Sanitario di numerose ASL lombarde (Milano, Bergamo, Lodi, etc.), “dai dati dell’indagine di sieroprevalenza dell’Istat svolta nell’estate del 2020 [58] emerge che circa l’85% dei malati Covid è stato infettato in ambienti confinati (in particolare, in quello domestico), non nella comunità. Tuttavia, nei periodi iniziali dell’epidemia la graduatoria dei luoghi di contagio numericamente più rilevanti è stata certamente rovesciata, con gli ambulatori medici e gli ambienti ospedalieri come primi luoghi di infezione, mentre le strutture sanitarie per anziani (le famose RSA) lo sono state successivamente (in quanto là sono stati ricoverati pazienti dimessi dagli ospedali o gli ospiti della struttura sono stati infettati dai propri parenti o da operatori presenti a loro volta infettati da terzi). In quella fase, l’ambito familiare è stato soltanto la terza fonte di propagazione epidemica, con cluster familiari piccoli ma molto numerosi (sia per i dimessi dall’ospedale rientrati al proprio domicilio che per i malati non ricoverati, nonché per i soggetti in quarantena e in attesa di evoluzione)”.
Naturalmente, l’importanza della trasmissione virale associata a diversi luoghi / tipologie di POI dipende sia dalla probabilità che la trasmissione avvenga entro un ambiente particolare sia dalla frequenza con cui le persone visitano quell’ambiente. E, come sottolinea il già citato studio americano apparso su Nature [7], “i luoghi associati a fattori di rischio di contagio più elevati e visitati frequentemente da molte persone è probabile che abbiano un impatto molto maggiore di quelli che hanno un rischio maggiore ma sono visitati raramente e da un numero inferiore di persone”. Anche di questo aspetto fondamentale della questione non sembra che sia stato tenuto conto nella strategia italiana. Né vi sono stati tentativi – almeno, pubblicamente noti – di affrontare tale problema da parte delle Autorità preposte, forse anche per la scarsa qualità dei dati forniti dal contact tracing, che da noi è stato fatto manualmente (per cui l’efficacia è necessariamente limitata [75]) e/o per l’incapacità di svolgere analisi così sui generis.
Sebbene il mio algoritmo permetta di capire in quali luoghi una persona abbia maggior rischio di infettarsi, la sorgente principale per sapere dove la gente realmente si infetta nel corso dell’epidemia rimane il contact tracing. Secondo analisi basate sul contact tracing effettuate nel Regno Unito [75], le attività collegate allo shopping e all’assembramento in ristoranti e pub generano la maggior parte delle infezioni (per cui la trasmissione – come del resto avvenuto in molti Paesi – è soprattutto comunitaria), ma a causa delle limitazioni dei dati queste conclusioni vanno prese con cautela. Naturalmente, il contact tracing è efficace anche per controllare la trasmissione del virus quando i tassi di infezione sono bassi, come mostrato dai successi conseguiti in molte nazioni asiatiche. Per tale motivo – e anche nell’ottica di future pandemie – è auspicabile che l’Italia adotti quanto prima un sistema di tracciamento digitale basato sulla tecnologia GPS (più che sul Bluetooth), giacché le motivazioni addotte per non farlo, relative alla privacy, sono risibili (la maggior parte di voi è già tracciata da Google, Facebook, etc.).
Il contact tracing nella sanità pubblica è – come ben noto – il processo di identificazione delle persone che possono essere venute in contatto con una persona infetta (“contatti”) e successiva raccolta di ulteriori informazioni su questi contatti. Il contact tracing è stato un pilastro del controllo delle malattie trasmissibili nella salute pubblica da decenni. L’eradicazione del vaiolo, ad esempio, è stata ottenuta non solo con l’immunizzazione universale tramite i vaccini, ma anche attraverso un tracciamento completo dei contatti per trovare tutte le persone infette [64]. Con l’introduzione della vaccinazione per la protezione contro l’infezione da SARS-CoV-2 e l’aumentata copertura vaccinale nei prossimi anni, la possibilità di pulire le sacche di infezione e di spegnere sul nascere i piccoli focolai dipenderà proprio da questo approccio [75], non certo dall’impiego del Green Pass (che va, anzi, esattamente nella direzione opposta!).
Il “testa, traccia e isola” è una delle pietre angolari della gestione di un’epidemia di Covid-19, e l’avere un tracciamento digitale via app è ancora più importante con varianti come la Delta, che presentano un elevato numero di potenziali casi secondari, difficilmente gestibile con il metodo manuale (occorre infatti tenere presente che una semplice elaborazione dei recenti dati grezzi provenienti da Islanda, Israele e Stati Uniti suggerisce che almeno l’80% dei vaccinati possono a loro volta trasmettere l’infezione se si contagiano, sebbene gli studi pubblicati – relativi a dati più vecchi – parlino ancora di numeri più bassi). Il sistema di tracciamento inglese fin dall’inizio registrava informazioni sui luoghi e sulle attività segnalate dalle persone, facilitando l’individuazione di quelli a maggior rischio. Naturalmente, i contatti segnalati dall’app sono tutti poi da verificare nei tempi e nei modi corretti, cosa che in Italia è stata fatta (e viene fatta ancora oggi) “alla carlona”, ovvero in modo molto superficiale.
Un recente articolo pubblicato ad agosto sul New England Journal of Medicine [68] sottolinea come, “se le app per il contact tracing digitale venissero affiancate alle altre misure di mitigazione, l’epidemia di Covid-19 potrebbe essere rallentata e virtualmente vi potrebbe essere posta la parola fine. Si possono trarre importanti lezioni dall’impiego di tecnologie digitali per aumentare la tracciabilità dei contatti durante questa pandemia. [..] I paesi che hanno avuto a livello mondiale il maggior successo nel combattere l’epidemia di Covid-19 sono stati quelli che hanno integrato con successo una capacità diagnostica scalata rapidamente e un sistema digitale di contact tracing con misure di isolamento e quarantena efficaci”. Lì opportuni cambiamenti legislativi (in fondo non molto diversi da quelli che da noi hanno reso – e renderanno – possibile il Green Pass) hanno fornito alle autorità sanitarie una base legale per l’utilizzo dei dati di geolocalizzazione per il tracciamento dei contatti fin dall’inizio dell’epidemia.
In taluni paesi asiatici, i dati del sistema di posizionamento globale (GPS) dei telefoni cellulari sono stati utilizzati per creare un database centralizzato dei movimenti delle persone con Covid-19 accessibile online. L’app ha utilizzato questi dati per avvisare gli utenti quando si trovavano vicino a un luogo visitato da una persona infetta. Questo intervento ha interferito con la privacy e la protezione dei dati delle persone infette (sebbene non molto più di quanto non facciano già le grandi multinazionali senza che noi neanche ce ne accorgiamo; si legga in proposito il libro Il capitalismo della sorveglianza [67]); tuttavia mirava a interrompere le catene di trasmissione per proteggere i membri più vulnerabili della società. Nella maggior parte dei paesi occidentali, all’inizio dell’epidemia non è stato attuato alcuno sforzo per migliorare la tracciabilità dei contatti utilizzando l’automazione, ed i risultati (pessimi) si sono visti [69].
Come spiega ancora l’articolo apparso sul NEJM [68], “senza una precedente esperienza nella risposta alle epidemie in questo modo, molti leader e cittadini hanno ritenuto inconcepibile che i diritti alla privacy e alla protezione dei dati personali potessero essere ceduti alla protezione della salute. Tuttavia, il fatto che molte persone nei paesi occidentali permettano già la raccolta di dati di geolocalizzazione da parte di altre app che forniscono scarsi benefici personali suggerisce che la resistenza a farlo per la protezione della salute, sebbene ben intenzionata, potrebbe essere stata fuorviante. Inoltre, oggi stanno emergendo prove del fatto che questi sistemi di contact tracing digitale, se correttamente implementati, sono stati utili nell’identificare un numero maggiore di contatti per caso rispetto al tradizionale contact tracing manuale”.
Insomma, gli autori dello studio in questione osservano che si dovrebbe puntare anche sull’“inoculazione digitale”, che peraltro sarebbe pure un’assicurazione contro nuove varianti del virus che aggirassero all’improvviso i vaccini e, contribuendo non poco ad abbassare l’Rt, ci permetterebbe maggiori libertà, come del resto sta avvenendo nel Regno Unito, dove non ci sono particolari restrizioni né, naturalmente, Green Pass. In effetti in Inghilterra, dopo il fallimento della prima app di contact tracing sviluppata nell’ambito del progetto “Test and Trace” del National Health Service (NHS), non si sono affatto scoraggiati – come invece ha fatto inspiegabilmente l’Italia – e una seconda app [71, 74], chiamata “NHS Covid-19” e rilasciata il 24 settembre 2020, ha funzionato così bene (fra l’altro a luglio di quest’anno risultava essere stata scaricata da ben 26 milioni di persone) da produrre il fenomeno della “pingdemic”, o pingdemia [70], così detto per le centinaia di migliaia di persone che sono state allertate per essere venute a contatto con un positivo e che, quindi, sono dovute rimanere in isolamento.
 Figura 10. L’app di contact tracing inglese. Il telefono dell’utente dell’app rileva gli altri nelle vicinanze, utilizzando il Bluetooth. Le persone che in seguito risultano positive al Covid possono condividere in modo anonimo il risultato del test, attivando avvisi per tutti coloro contrassegnati come contatti stretti nei giorni precedenti il test: in pratica, si tratta di tutti i dispositivi altrui venuti a una distanza di 2 m o meno, per un minimo di 15 minuti. L’app è stata fatta scaricare alla gente facendone capire l’utilità, non rendendola obbligatoria o usando metodi coercitivi (esattamente l’opposto di quanto ha fatto l’Italia con i vaccini), ed in effetti questo approccio si è dimostrato un successo per l’elevatissimo numero di download.
Figura 10. L’app di contact tracing inglese. Il telefono dell’utente dell’app rileva gli altri nelle vicinanze, utilizzando il Bluetooth. Le persone che in seguito risultano positive al Covid possono condividere in modo anonimo il risultato del test, attivando avvisi per tutti coloro contrassegnati come contatti stretti nei giorni precedenti il test: in pratica, si tratta di tutti i dispositivi altrui venuti a una distanza di 2 m o meno, per un minimo di 15 minuti. L’app è stata fatta scaricare alla gente facendone capire l’utilità, non rendendola obbligatoria o usando metodi coercitivi (esattamente l’opposto di quanto ha fatto l’Italia con i vaccini), ed in effetti questo approccio si è dimostrato un successo per l’elevatissimo numero di download.
Dunque, un’app di contact tracing sarebbe per l’Italia un ausilio prezioso per abbassare la circolazione virale, in quanto faciliterebbe l’individuazione dei positivi (cosa di grande importanza, perché ora la maggior parte di essi non li “vediamo”); e questo è il primo passo per far sì che essi poi non la trasmettano ad altri. Come segnalatomi dal dr. Imbalzano, “ridurre il numero di casi di Covid è fondamentale, e un’azione di mitigazione del rischio è essenziale per non creare una recrudescenza delle infezioni (che sono comunque largamente sottostimate nella gestione quotidiana delle Regioni) e costringere a chiusure più rigide. Infatti, le prime chiusure delle scuole a pochi giorni dall’apertura dell’anno scolastico mostrano che un gran numero di positivi non sono stati identificati per un tracciamento molto claudicante delle Regioni, che vogliono minimizzare la presenza di casi di infezione e lasciare aperte le attività commerciali, che generano nuovi casi alimentando ricoveri e decessi, in particolare in Sicilia, che ha una mortalità molto significativa (non a caso, si tratta della regione d’Italia con il tasso di vaccinazione più basso)”.
Infine, nella puntata della trasmissione Di Martedì del 4 maggio 2021 (minuti 36-38), è stata mostrata la misurazione, fatta con un misuratore di anidride carbonica (CO2) commerciale, del livello di CO2 in alcuni luoghi pubblici indoor. Ebbene, i valori mostrati erano dell’ordine di 3600 ppm in un bagno pubblico e di 6300 ppm in un autogrill autostradale, ovvero altissimi e quasi certamente non in linea con quelli che la norma UNI 10339 di fatto comporterebbe (essa, infatti, non norma direttamente questo parametro, bensì soprattutto il tasso di ricambio d’aria e l’occupazione massima di un ambiente, due parametri che, insieme, determinano evidentemente un valore di CO2 massimo atteso, o meglio un intervallo di valori di CO2 attesi, poiché la CO2 prodotta dalle persone dipende in misura abbastanza rilevante dall’attività svolta). Pertanto, il mio sospetto è che questa norma in Italia sia stata largamente disattesa, per cui sarebbe opportuno procedere a misurazioni a campione in vari luoghi pubblici indoor – e in vari periodi dell’anno – per verificare il corretto ricambio d’aria, cosa mai fatta in un anno e mezzo di pandemia!
La triplice utilità della mascherina (e di un costante ricambio d’aria) in ambienti indoor
L’importanza del ricambio d’aria per ridurre sia la probabilità di infezione sia la dose virale assorbita è ancora più importante con la variante Delta, come dimostrato da quanto avvenuto (ed è stato documentato da telecamere) questa primavera in un supermercato di Sidney, in Australia, dove c’è stato un contagio fra due persone senza mascherina, nonostante queste si siano semplicemente incrociate in una corsia dello stesso senza che avessero parlato né emesso droplet [45]. Inoltre, la carica virale delle infezioni con la variante Delta è circa 1.000 volte superiore rispetto a quelle con la variante originale di Wuhan [48]. Donde l’importanza ancora più grande dell’uso di mascherine in ambienti indoor e del ricambio d’aria con l’esterno, dato che gli aerosol respiratori al chiuso si accumulano, un po’ come fa il fumo di sigaretta. E, come con il fumo, dobbiamo rimediare aerando costantemente l’ambiente, ad esempio aprendo le finestre, ma meglio ancora usando dei sistemi di ventilazione automatici con l’esterno.
Come spiegano due esperti di alto livello – un noto epidemiologo americano e il Vice Direttore delle Malattie Infettive dei CDC statunitensi – sulla nota rivista medica JAMA [52], “dati convincenti ora dimostrano che l’indossare la mascherina in pubblico è un intervento non farmacologico efficace per ridurre la diffusione di quest’infezione, soprattutto come controllo della sorgente per prevenire la diffusione da persone infette, ma anche come protezione per ridurre l’esposizione di chi la indossa alle infezioni. L’uso di mascherine in pubblico riduce sostanzialmente la trasmissione del SARS-CoV-2 in 2 modi:
- Innanzitutto, le mascherine impediscono alle persone infette di esporre gli altri al SARS-CoV-2 bloccando l’esalazione di goccioline contenenti virus nell’aria. Questo aspetto dell’uso della mascherina (che si chiama in gergo “controllo della fonte”) è particolarmente importante perché si stima che almeno il 50% o più delle trasmissioni provenga da persone che non hanno sviluppato disturbi o che sono nella fase presintomatica della malattia da COVID-19. In recenti esperimenti di laboratorio, le mascherine di stoffa multistrato si sono dimostrare più efficaci di quelle a strato singolo, bloccando dal 50% al 70% delle piccole goccioline e particelle espirate.
- Secondo, le mascherine proteggono i non infetti che le usano. Esse formano una barriera alle grandi vie respiratorie per le goccioline che potrebbero atterrare sulle mucose esposte di naso e bocca. Le mascherine possono anche filtrare parzialmente le piccole goccioline e particelle dall’aria inalata, proteggendo chi le indossa dall’infezione, come dimostrato in passato per altri virus respiratori [55]. Più strati di tessuto migliorano la filtrazione. Tuttavia, l’efficacia osservata delle mascherine in tessuto per proteggere chi lo indossa è inferiore alla loro efficacia per il controllo della fonte, e la capacità di filtrazione delle mascherine in tessuto può essere altamente dipendente dal design, dalla vestibilità e dai materiali utilizzati”. Ed, ovviamente, è importante che siano certificate.
Pertanto, il semplice obbligo di indossare le mascherine in ambiente indoor contribuisce a proteggere i non immunizzati (cioè sia i non vaccinati sia la percentuale di vaccinati che non è protetta dal vaccino). Inoltre, le mascherine (quelle certificate!) contribuiscono in modo rilevante ad abbassare il valore dell’Rt: indagini epidemiologiche condotte in tutto il mondo, specialmente nei paesi asiatici che si sono abituati al mascheramento di tutta la popolazione durante la pandemia di SARS del 2003, hanno suggerito che esiste una forte relazione tra il mascheramento pubblico e il controllo della pandemia [55]. Per cui le mascherine sono un po’ come le barre di grafite in un reattore nucleare: aiutano a impedire una reazione (nel nostro caso una diffusione) incontrollata. Un discorso simile, peraltro, si può fare per il ricambio d’aria negli ambienti indoor. Dunque, le mascherine esercitano una duplice funzione; anzi, in realtà triplice.
Infatti le mascherine, dal momento che riducono la dose virale assorbita, possono ridurre anche (oltre al rischio di infezione) la gravità della malattia sviluppata nel caso in cui la mascherina non sia sufficiente a impedire il contagio; per cui questi dispositivi di protezione individuale dovrebbero contribuire anche ad aumentare l’immunità della popolazione. Difatti, come ha spiegato il prof. Hassan Vally, epidemiologo a La Trobe University (Australia), “sappiamo che le mascherine proteggono le persone dall’infezione, ma anche se non si impedisce completamente che ciò accada – quindi se si lascia entrare solo un piccolo numero di particelle di virus – allora potenzialmente ci si espone a una quantità sufficiente di virus affinché tu possa organizzare una risposta immunitaria che ti proteggerà in futuro” [53].
L’uso di massa delle mascherine in ambiente indoor può anche aiutare a ridurre la gravità della malattia (oltre a garantire, come appena visto, che una percentuale maggiore di nuove infezioni sia asintomatica). Come spiegano infatti altri due esperti sul New England Journal of Medicine [55], “ciò è diventato evidente a marzo 2020, quando hanno iniziato a circolare rapporti che descrivevano gli alti tassi di diffusione virale di SARS-CoV-2 dal naso e dalla bocca di pazienti presintomatici o asintomatici: tassi di diffusione equivalenti a quelli tra pazienti sintomatici. Il mascheramento facciale di massa sembrava essere un modo possibile per prevenire la trasmissione da persone infette asintomatiche. Il 3 aprile 2020 i Centri per il controllo e la prevenzione delle malattie (CDC) statunitensi hanno quindi raccomandato al pubblico di indossare rivestimenti per il viso in tessuto nelle aree con alti tassi di trasmissione comunitaria”.
In effetti, il SARS-CoV-2 ha la capacità proteiforme di causare una miriade di manifestazioni cliniche, che vanno dalla completa assenza di sintomi alla polmonite, alla sindrome da distress respiratorio acuto e alla morte. A portare al’ipotesi che il mascheramento facciale possa anche ridurre la gravità della malattia tra le persone che vengono infettate sono stati dati virologici, epidemiologici ed ecologici recenti [56]. Questa possibilità è coerente con una teoria di vecchia data sulla patogenesi virale, che sostiene che la gravità della malattia è proporzionale all’inoculo virale ricevuto. Dal 1938, i ricercatori hanno esplorato, principalmente in modelli animali, il concetto di dose letale di un virus, ovvero la dose alla quale muore il 50% degli ospiti esposti (LD50). Con le infezioni virali in cui le risposte immunitarie dell’ospite svolgono un ruolo predominante nella patogenesi virale – come nel caso del SARS-CoV-2 – alte dosi di inoculo virale possono sopraffare e disregolare le difese immunitarie innate, aumentando la gravità della malattia [55].
Come prova del concetto di inoculi virali che influenzano le manifestazioni della malattia, dosi più elevate di virus somministrato hanno portato a delle manifestazioni più gravi di Covid-19 in un modello di criceto siriano di infezione da SARS-CoV-2 [57]. Se l’inoculo virale è importante nel determinare la gravità dell’infezione da SARS-CoV-2, un’ulteriore ragione importante per indossare mascherine facciali in ambiente indoor sarebbe quella di ridurre l’inoculo virale a cui è esposto chi le indossa e il successivo impatto clinico della malattia. Poiché le mascherine possono filtrare alcune goccioline contenenti virus (con capacità di filtraggio determinata dal tipo di mascherina), il mascheramento potrebbe ridurre l’inoculo inalato da una persona esposta. Di conseguenza, l’uso delle mascherine potrebbe contribuire ad aumentare la percentuale di infezioni da SARS-CoV-2 che sono asintomatiche [55].
Non a caso, il tasso tipico di infezione asintomatica con SARS-CoV-2 è stato stimato dal CDC a luglio 2020 del 40%, ma è stato riportato che i tassi di infezione asintomatica sono superiori all’80% in ambienti con mascheramento facciale [55]. I paesi che hanno adottato il mascheramento a livello di popolazione sono andati meglio in termini di tassi di gravi malattie e decessi legati al Covid, il che, in ambienti con disponibilità di test/tamponi limitati (come alcuni Paesi più poveri), suggerisce un passaggio da infezioni sintomatiche ad asintomatiche. Un altro esperimento nel modello del criceto siriano ha simulato il mascheramento chirurgico degli animali e ha mostrato che, con il mascheramento simulato, i criceti avevano meno probabilità di essere infettati e, se si infettavano, erano asintomatici o avevano sintomi più lievi rispetto ai criceti non mascherati [55]. In definitiva, combattere la pandemia comporterà sia la riduzione dei tassi di trasmissione che quella della gravità della malattia.
 Tabella 5. I principali fattori di rischio noti per esito infausto del Covid-19 (o comunque per lo sviluppo di forme più gravi della malattia Covid-19). Si noti come si possa agire solo su quattro di essi, ma le Autorità sanitarie ed i decisori politici italiani poco o nulla hanno fatto (e tuttora poco o nulla fanno) per agire su di essi, nonostante l’enorme impatto in termini di morti aggiuntivi che l’averli trascurati ha comportato e comporta ancora. Al contrario, nella gestione della pandemia in Italia sono state prese molte decisioni che contrastano con quello che ci insegnano gli studi in materia (basti pensare a quando, all’inizio della pandemia, i “medici da salotto televisivo” ci dicevano con grande sicurezza che “le mascherine sono inutili”) e sono in disaccordo anche con le più semplici simulazioni numeriche, i due principali strumenti che ci aiutano a capire a fondo il problema in modo da poter indirizzare le scelte verso strategie mirate. La dose virale assorbita si può ridurre, in particolare, con l’uso delle mascherine e con il ricambio d’aria; ovviamente, essi contribuiscono anche a ridurre il rischio di infezione e il famoso Rt , da cui la loro azione “triplice”.
Tabella 5. I principali fattori di rischio noti per esito infausto del Covid-19 (o comunque per lo sviluppo di forme più gravi della malattia Covid-19). Si noti come si possa agire solo su quattro di essi, ma le Autorità sanitarie ed i decisori politici italiani poco o nulla hanno fatto (e tuttora poco o nulla fanno) per agire su di essi, nonostante l’enorme impatto in termini di morti aggiuntivi che l’averli trascurati ha comportato e comporta ancora. Al contrario, nella gestione della pandemia in Italia sono state prese molte decisioni che contrastano con quello che ci insegnano gli studi in materia (basti pensare a quando, all’inizio della pandemia, i “medici da salotto televisivo” ci dicevano con grande sicurezza che “le mascherine sono inutili”) e sono in disaccordo anche con le più semplici simulazioni numeriche, i due principali strumenti che ci aiutano a capire a fondo il problema in modo da poter indirizzare le scelte verso strategie mirate. La dose virale assorbita si può ridurre, in particolare, con l’uso delle mascherine e con il ricambio d’aria; ovviamente, essi contribuiscono anche a ridurre il rischio di infezione e il famoso Rt , da cui la loro azione “triplice”.
Non rimane che il fai-da-te: la verifica del grado di ricambio d’aria e un semplice sistema VMC
La verifica del corretto ricambio d’aria in un qualsivoglia ambiente indoor non è affatto una scienza complicata, come forse le Autorità sanitarie ed i decisori politici italiani pensano, dato che, anziché ammettere i propri errori sull’aver trascurato la scuola (con il risultato che sono almeno già migliaia gli studenti costretti di nuovo alle lezioni a distanza), ammassano gli studenti nelle aule con un distanziamento di appena un metro e neppure obbligatorio [44], e pensano solo a vaccinare i bambini. Cosa che ha un rapporto rischi/benefici sfavorevole, come ben noto anche all’estero (dove non a caso molti esperti invitano alla cautela), oltre a essere una scelta secondo alcuni non lungimirante, poiché come ha spiegato ad es. il prof. Giancarlo Zuccotti, preside della Facoltà di Medicina all’Università Statale di Milano e responsabile della Pediatria all’Ospedale Sacco: “Fra i banchi l’infezione da Covid va trattata come l’influenza. Anzi, tenendo in circolazione il virus i più piccoli aiutano a renderlo endemico” [40, 41]. In effetti, secondo un recente studio, l’immunità guadagnata dopo il recupero dal Covid-19 (variante Delta) è circa 13 volte più forte di quella ottenuta con due dosi del vaccino Pfizer [46].
Ciò premesso, se aspettiamo che siano le nostre Autorità politiche e sanitarie a fare controlli per capire in quali posti il ricambio d’aria è insufficiente e andrebbe quindi adeguato, o decidere di dotare le aule scolastiche dei sistemi di Ventilazione Meccanica Controllata (VMC), allora “campa cavallo…”. Perciò, ecco come possiamo procedere da soli intanto alla stima del grado di ricambio d’aria (a casa, a scuola, in ufficio o in altri ambienti indoor) in maniera indiretta: tramite la semplice misurazione del livello di anidride carbonica (CO2) nell’aria, fatta attraverso un misuratore commerciale low-cost. Naturalmente, i valori così trovati non hanno alcun valore probatorio (né, tanto meno, squisitamente legale se la misurazione viene effettuata con tali apparecchi in ambiente di lavoro); in particolare, più che per avere valori assoluti, gli strumenti low cost sono in generale utili per effettuare misurazioni relative, cioè per confrontare il livello di CO2 in diversi ambienti indoor (quelli in cui risulterà più alto, naturalmente, sono più pericolosi a parità di altre condizioni, perché vuol dire che in essi c’è un minor ricambio d’aria).
Il livello della CO2 all’esterno (outdoor), cioè atmosferico, è arrivato oggi al valore di 400 ppm (come ben sa chi conosce il grafico che spesso si mostra quando si parla del riscaldamento globale). Tuttavia, si tratta di un livello medio, e nella realtà varia – a seconda dei giorni – grosso modo fra 350 e 450 ppm; per cui, se acquistate un misuratore di CO2 low-cost, non taratelo con il livello di CO2 esterno (sebbene ve ne sia in genere la possibilità), poiché questi apparecchi sono già tarati in fabbrica usando un metodo più preciso. Un livello tipico di CO2 negli ambienti con un buon ricambio d’aria è di 450-1000 ppm (personalmente, a casa cerco di non superare i 600 ppm). La figura qui sotto mostra l’impatto, tratta da un documento di esperti del settore [42], del livello di CO2 sulle prestazioni cognitive umane. Come si vede, le prestazioni specifiche influenzate sono parecchie e, a causa della correlazione inversa fra il livello di CO2 e le prestazioni in questione, è preferibile mantenere livelli di CO2 il più bassi possibile. A prescindere dal Covid!
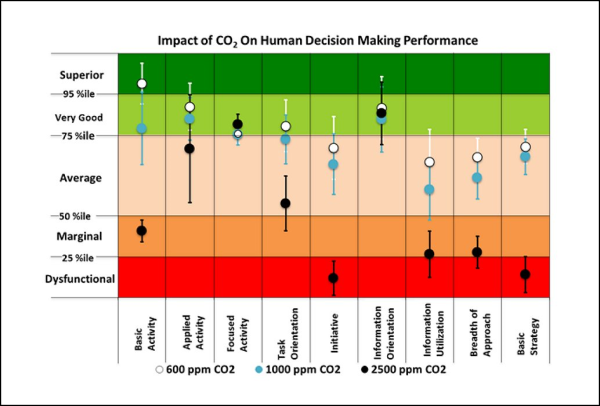 Figura 11. L’impatto del livello di anidride carbonica sulle prestazioni cognitive umane. Osservando la figura in dettaglio, si può capire bene l’importanza di avere un buon ricambio d’aria in un’aula scolastica, o sull’ambiente di lavoro, anche a prescindere dal discorso del Covid. Eppure le Autorità sanitarie ed i decisori politici italiani sembrano ignorare tutto ciò, come se vivessero su un altro pianeta. (fonte: Fisk et al. [42])
Figura 11. L’impatto del livello di anidride carbonica sulle prestazioni cognitive umane. Osservando la figura in dettaglio, si può capire bene l’importanza di avere un buon ricambio d’aria in un’aula scolastica, o sull’ambiente di lavoro, anche a prescindere dal discorso del Covid. Eppure le Autorità sanitarie ed i decisori politici italiani sembrano ignorare tutto ciò, come se vivessero su un altro pianeta. (fonte: Fisk et al. [42])
Un misuratore low-cost di CO2 può costare tipicamente fra 50 e 100 euro, a seconda del portale di e-commerce presso cui lo si acquista, ma è utile anche a prescindere dal discorso del Covid, in quanto se usato in una casa o in un ufficio ci dice non soltanto quando l’aria ha raggiunto livelli assai elevati di CO2 (che percepiamo da soli come “aria viziata”, ad esempio in un classe con le finestre chiuse per 2 ore di seguito), ma ci dice anche quando i livelli di CO2 raggiunti sono comunque più alti di quelli desiderabili, ovvero non tanto alti da essere percepibili come “aria viziata” dal nostro olfatto, ma abbastanza alti da incidere tuttavia sulle capacità cognitive di una persona. Non a caso, la CO2 è comunemente inclusa nel monitoraggio della qualità dell’aria in ambiente indoor, e un misuratore di CO2 ci aiuterà a capire – d’inverno come d’estate – quando è il momento di aprire (o chiudere) le finestre, in modo da massimizzare il livello di qualità dell’aria e da minimizzare il dispendio energetico.
Infatti, quando la differenza di temperatura fra l’interno e l’esterno della casa è elevato, come ad es. d’inverno, possono bastare pochi minuti con le finestre aperte per garantire un efficace ricambio dell’aria, mentre durante le mezze stagioni occorrerà tenere le finestre aperte molto più a lungo. Per evitare il conseguente dispendio energetico se non possiamo stare ogni volta a misurare il livello di CO2 per ottimizzare il tempo di ricambio dell’aria, si può realizzare un sistema di Ventilazione Meccanica Controllata praticando (o facendo praticare) un foro nel muro perimetrale della casa (c’è già se la caldaia a gas è interna) e applicando poi nel foro un cosiddetto “estrattore d’aria a recupero di calore”: in pratica, una ventola con in più uno speciale materiale ceramico che funge da scambiatore di calore. Questi apparecchi trattengono almeno il 90% del calore quando l’aria passa, ed effettuano il ricambio d’aria h24 (o nella fascia oraria da voi scelta), per cui garantiscono una costante ed eccellente qualità dell’aria facendo risparmiare circa il 20% sulla bolletta energetica per riscaldamento e raffrescamento della casa (o dell’aula).
Un apparecchio di questo tipo costa circa 300 €, ed oggi ve ne è una vasta scelta di marche e modelli, perché il brevetto (tedesco) dello scambiatore di calore ceramico è ormai scaduto da alcuni anni. Quindi, se si vanno a fare dei semplici conti tenendo presente la spesa per la climatizzazione annua di una casa italiana tipica o di un’aula scolastica, si scopre che il tempo di rientro dell’investimento è brevissimo: di circa 2-3 anni se siete alle latitudini del Nord Italia. Si noti che la maggior parte degli estrattori d’aria sono monodirezionali, per cui in tal caso serviranno due buchi nel muro (tipicamente in parti opposte della casa, ad es. cucina e camera da letto). Ma esistono anche apparecchi (come ad es. il Ventolino) che all’incirca ogni 3 minuti invertono il movimento della ventola, per cui un solo buco è sufficiente. Se non vi interessa il recupero del calore, potete anche semplicemente usare – come ho fatto a casa mia – 2 ventole per il bagno (una per buco), dimmerarle per ridurre quasi a zero il rumore, e infine aggiungere un temporizzatore meccanico programmabile per impostare la fascia oraria in cui cambiare l’aria. Costo totale: 100 €!
Infine, come pubblicato nelle scorse settimane dai media (ad es. nell’articolo “Contenere il Covid misurando la CO2 nell’aria: test in due scuole” [43]), un sistema per il controllo della qualità dell’aria dal costo di 50 €, progettato specificamente per contenere il contagio da Covid-19 con un metodo messo a punto dall’ing. Buonanno (Università di Cassino) e promosso dall’Associazione nazionale tutela energie rinnovabili (Anter), sarà sperimentato a breve in due scuole: l’Istituto comprensivo di Praia a Mare (Cosenza) e il 2° Istituto Comprensivo di Ferentino (Frosinone). In realtà, ora sapete come effettuare da soli le misurazioni con un misuratore commerciale di CO2 e perfino come fare un sistema di Ventilazione Meccanica Controllata con una spesa irrisoria; ma la novità di Buonanno (come pure del presente articolo, del resto) è l’aver fornito un algoritmo che consente una valutazione del rischio. In realtà, già anni fa il fisico Alessandro Ciucci, docente in una scuola superiore di Livorno, aveva misurato (v. figura qui sotto) l’aumento del livello di CO2 in una classe con un sensore di CO2 commerciale accoppiato a una scheda Arduino. Insomma, si può fare!
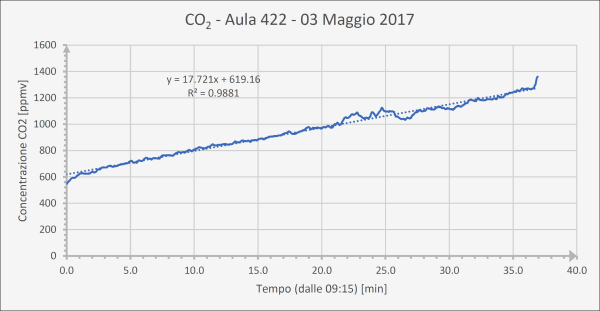 Figura 12. L’aumento del livello di CO2 in una classe con 16 persone (15 studenti e l’insegnante) realizzato usando un sensore NIR interfacciato con una scheda Arduino Nano (per l’acquisizione dei dati sul PC). Il sistema è stato acceso alle ore 9:00 del 3 maggio 2017, quando sono state aperte per 15 minuti le finestre e la porta per garantire un ricambio d’aria (dopo 5 minuti dall’accensione è stata eseguita la procedura di calibrazione interna del sensore). Alle 9:15, chiuse le porte e le finestre, gli studenti sono stati invitati a non uscire ed è iniziata la registrazione della misura della concentrazione di CO2 mostrata dal grafico (al ritmo di una misura al secondo). Alle 10:00 sono state aperte nuovamente le finestre e la porta ed è stato osservato che la concentrazione di CO2 è tornata ai livelli dell’ora precedente. Si riporta in figura il grafico dei primi 45 minuti di misura, cioè mentre le porte e le finestre erano chiuse. L’aula ha un volume complessivo di 201 metri cubi, ed il trend di aumento della CO2 è risultato essere di 17,7 ppm/min (o, per essere più precisi, ppmv/min, solo per ricordare che sono parti per milione in volume). (fonte: Alessandro Ciucci)
Figura 12. L’aumento del livello di CO2 in una classe con 16 persone (15 studenti e l’insegnante) realizzato usando un sensore NIR interfacciato con una scheda Arduino Nano (per l’acquisizione dei dati sul PC). Il sistema è stato acceso alle ore 9:00 del 3 maggio 2017, quando sono state aperte per 15 minuti le finestre e la porta per garantire un ricambio d’aria (dopo 5 minuti dall’accensione è stata eseguita la procedura di calibrazione interna del sensore). Alle 9:15, chiuse le porte e le finestre, gli studenti sono stati invitati a non uscire ed è iniziata la registrazione della misura della concentrazione di CO2 mostrata dal grafico (al ritmo di una misura al secondo). Alle 10:00 sono state aperte nuovamente le finestre e la porta ed è stato osservato che la concentrazione di CO2 è tornata ai livelli dell’ora precedente. Si riporta in figura il grafico dei primi 45 minuti di misura, cioè mentre le porte e le finestre erano chiuse. L’aula ha un volume complessivo di 201 metri cubi, ed il trend di aumento della CO2 è risultato essere di 17,7 ppm/min (o, per essere più precisi, ppmv/min, solo per ricordare che sono parti per milione in volume). (fonte: Alessandro Ciucci)
RINGRAZIAMENTI. Vorrei esprimere la mia profonda gratitudine al prof. Giorgio Vassallo, fisico e docente presso il Dipartimento dell’Innovazione industriale e Digitale dell’Università di Palermo, e al dr. Giuseppe Imbalzano, noto medico specializzato in Igiene e Medicina Preventiva, per la disponibilità alla lettura critica del manoscritto. Naturalmente, la responsabilità di eventuali inesattezze residue, nonché delle valutazioni espresse, è solo ed esclusivamente dell’Autore. Desidero inoltre ringraziare, per alcuni commenti sul presente articolo e per le utili discussioni precedenti avute su alcuni temi in esso contenuti, Valerio Cinti, fisico con un solido background chimico e tecnologico, che ha lavorato alla “Divisione Innovazione e Ricerca” presso il Centro ricerche dell’ENEL di Pisa. Infine, ringrazio il fisico Alessandro Ciucci per aver condiviso la sua interessante esperienza nella misurazione dell’aumento dei livelli di CO2 in un’aula scolastica, che peraltro ha confermato in maniera lampante l’importanza del ricambio d’aria in quel tipo di ambiente.
Riferimenti bibliografici
[1] Menichella M., “ ‘Pillole’ anti-COVID: quelle che non vi hanno mai dato”, Fondazione David Hume, 25 marzo 2021.
[2] Robilotti E. et al., “Norovirus”, Clinical Microbiology Reviews, 2015.
[3] Istituto Superiore di Sanità, “Caratteristiche dei pazienti deceduti positivi all’infezione da SARS-CoV-2 in Italia – Dati al 1° marzo 2021”, EpiCentro, marzo 2020.
[4] Menichella M., “Vitamina D e minore mortalità per COVID: le evidenze e il suo uso per prevenzione e cura”, Fondazione David Hume, 23 febbraio 2021.
[5] Infante M. et al., “Low Vitamin D Status at Admission as a Risk Factor for Poor Survival in Hospitalized Patients With COVID-19: An Italian Retrospective Study”, J. Am. Coll. Nutr., Febbraio 2021.
[6] Rapporto ISS COVID-19 n. 63/2020: “Apertura delle scuole e andamento dei casi confermati di SARS-CoV-2: la situazione in Italia”, ISS.it, versione del 30 dicembre 2020.
[7] Chang S. et al., “Mobility network models of COVID-19 explain inequities and inform reopening”, Nature, 10 novembre 2020.
[8] Birge, J. et al., “Controlling epidemic spread: reducing economic losses with targeted closures”, BFI Working Paper No. 2020-57, 8 May 2020.
[9] Menichella M., “Il ‘boom’ dei prezzi e l’impatto del lockdown: l’Italia rischia ora la ‘tempesta perfetta’ ”, Fondazione David Hume, 21 aprile 2021.
[10] Fernstrom A., “Aerobiology and Its Role in the Transmission of Infectious Diseases”, Journal of Path
[11] Doremalen N. et al., “Aerosol and Surface Stability of SARS-CoV-2 as Compared with SARS-CoV-1”, Letter, The New England Journal of Medicine, Aprile 2020.
[12] Doremalen N. et al., “Aerosol and Surface Stability of SARS-CoV-2 as Compared with SARS-CoV-1”, Lettera all’Editore, The New England Journal of Medicine, 16 aprile 2020.
[13] Rabaan A. et al., “Airborne transmission of SARS-CoV-2 is the dominant route of transmission: droplets and aerosols”, Le Infezioni in Medicina, n°1, 2021.
[14] Wang J. & Du G., “COVID-19 may transmit through aerosol”, Irish Journal of Medical Science, 2020.
[15] Morawska L & Cao J., “Airborne transmission of SARSCoV-2: the world should face the reality”, Environment International, 2020.
[16] ExpoClima, “La UNI 10339, il ricambio dell’aria negli impianti aeraulici”, ExpoClima.net. https://www.expoclima.net/dossier/33/la_uni_10339_il_ricambio_dell_aria_negli_impianti_aeraulici.htm
[17] Sola P., “Lezione sugli impianti di ventilazione meccanica”, salesianilombriasco.it. http://www.salesianilombriasco.it/public/20150206714164164146331003588441881539407353264463234553.pdf
[18] Beggs C.B., “Is there an airborne component to the transmission of COVID-19?: a quantitative analysis study”, medRxiv, maggio 2020.
[19] Fabian P. et al, “Origin of Exhaled Breath Particles from Healthy and Human Rhinovirus-Infected Subjects”, J. Aerosol Med. Pulm. Drug Deliv., 2011.
[20] Papineni R.S. & Rosenthal F.S., “The size distribution of droplets in the exhaled breath of healthy human subjects”, J. Aerosol Med., 1997.
[21] Lu J. et al., “COVID-19 Outbreak Associated with Air Conditioning in Restaurant, Guangzhou, China, 2020”, Emerging Infectious Diseases Journal, luglio 2020.
[22] Park S.Y. et al., “Coronavirus Disease Outbreak in Call Center, South Korea”, Emerging Infectious Diseases Journal, agosto 2020.
[23] Contini C. & Fadiga L., “Modalità di contagio di COVID-19”, unife.it, 7 dicembre 2020.
[24] Buonanno G., “La trasmissione aerea del COVID19: il grande errore commesso”, Fondazione David Hume, 9 marzo 2021. https://www.fondazionehume.it/in-primo-piano/la-trasmissione-aerea-del-covid19-il-grande-errore-commesso/
[25] Redazione MyPersonal, “Frequenza respiratoria – Respiri al minuto”, my-personaltrainer.it.
[26] Redazione Lega Polmonare, “I Polmoni – l’organo essenziale per la nostra respirazione”, legapolmonare.ch.
[27] Redazione Indire, “I rischi posti dalla contaminazione indoor di Anidride Carbonica, forum.indire.it.
[28] Han z.Y., “Characterizations of particle size distribution of the droplets exhaled by sneeze”, Journal of the Royal Society Interface, 2013.
[29] Geddes L., “Does a high viral load or infectious dose make Covid-19 worse?”, New Scientist, 27 marzo 2020.
[30] De Oliveira P.M. et al., “Evolution of spray and aerosol from respiratory releases: theoretical estimates for insight on viral transmission”, Proceedings of the Royal Society A, 20 gennaio 2021.
[31] Balachandar S. et al., “Host-to-host airborne transmission as a multiphase flow problem for science-based social distance guidelines”, Int. J. of Multiphase Flow, novembre 2020.
[32] Chan J. et al., “Surgical mask partition reduces the risk of non-contact transmission in a golden Syrian hamster model for Coronavirus Disease 2019 (COVID-19)”, Clin. Infect. Dis., 30 maggio 2020.
[33] Regis A., “I limiti e le responsabilità imposti dalla normativa scolastica ai dirigenti scolastici nella formazione delle classi”, ReteScuole, 28 luglio 2007.
[34] Paola A., “Metropolitane: Sicurezza e rischi”, Obiettivo Sicurezza, vigilfuoco.it.
[35] Redazione Italian Tribune, “Matteo Bassetti: Nelle stanze dei malati Covid nessuna traccia di virus nell’aria”, theitaliantribune.it, 6 maggio 2021.
[36] Da Rold C., “Che aria si respira in metropolitana?”, rivistamicron.it, 23 lugio 2017.
[37] Setti L., “Potential role of particulate matter in the spreading of COVID-19 in Northern Italy: first observational study based on initial epidemic diffusion”, British Medical Journal, 2020.
[38] Bulfone T.C. et al., “Outdoor Transmission of SARS-CoV-2 and Other Respiratory Viruses: A Systematic Review”, The Journal of Infectious Diseases, 15 febbraio 2021.
[39] Chirizzi D. et al., “SARS-CoV-2 concentrations and virus-laden aerosol size distributions in outdoor air in north and south of Italy”, Environment International, gennaio 2021.
[40] “Il pediatra Zuccotti: ‘Basta quarantene per le scuole. Trattiamo il Covid nei bambini come se fosse un’influenza’ ”, OrizzonteScuola.it, 19 settembre 2021.
[41] Floder Reitter P., “Lasciate in classe gli asintomatici. Non rischiano e fanno gli anticorpi”, La Verità, 21 settembre 2021.
[42] Fisk W.J. et al., “Is CO2 an indoor pollutant?”, REHVA (Federation of European Heating, Ventilation, and Air Conditioning Associations), 2013.
[43] Battaglia A., “Contenere il Covid misurando la CO2 nell’aria: test in due scuole”, Wall Street Italia, 17 settembre 2021.
[44] Ricolfi L., “Studenti allo sbaraglio”, da Il Messaggero su Fondazione David Hume, 14 settembre 2021.
[45] Lu D., “Covid Delta variant is ‘in the air you breathe’: what you need to know about Sydney outbreak strain”, The Guardian, 29 giugno 2021.
[46] Solis-Moreira J., “L’immunità naturale di infezione SARS-CoV-2 protegge meglio dalla variante Delta che la vaccinazione?”, News Medical, 30 agosto 2021.
[47] Menichella M., “Tutto quello che non vi dicono sulle cure domiciliari precoci per il Covid-19 (e perché lo fanno)”, Fondazione David Hume, 14 settembre 2021.
[48] Reardon S., “How the Delta variant achieves its ultrafast spread”, Nature, 21 luglio 2021.
[49] Villers J. et al., “SARS-CoV-2 aerosol transmission in schools: the effectiveness of different interventions”, preprint, medRxiv, 20 agosto 2021.
[50] “Per la scienza i contagi a scuola sono pochi, ma in Italia non ci sono dati per dirlo”, Pagella politica, 20 settembre 2021.
[51] Fears A.C. et al., “Persistence of Severe Acute Respiratory Syndrome Coronavirus 2 in Aerosol Suspensions”, Emerg. Infect. Dis., 26 settembre 2020.
[52] Brooks J.T. & Butler J.C., “Effectiveness of MaskWearing to Control Community Spread of SARS-CoV-2”, JAMA, 9 marzo 2021.
[53] Lewin E., “Can face masks reduce COVID severity and improve herd immunity?”, News GP, 18 settembre 2020.
[54] Buonanno G. “Come il mito dei droplets ha sostituito (fino ad oggi) la trasmissione aerea”, Fondazione David Hume, 15 giugno 2021.
[55] Gandhi M. & Rutherford G.W., “Facial Masking for Covid-19 — Potential for ‘Variolation’ as We Await a Vaccine”, NEJM, 8 settembre 2020.
[56] Gandhi M. et al., “Masks Do More Than Protect Others During COVID-19: Reducing the Inoculum of SARS-CoV-2 to Protect the Wearer”, J. Gen. Intern. Med., ottobre 2020.
[57] Imai M. et al., “Syrian hamsters as a small animal model for SARS-CoV-2 infection and countermeasure development”, PNAS, 14 luglio 2020.
[58] Istat – Ministero della Salute, “Primi risultati dell’indagine di sieroprevalenza sul SARS-CoV-2”, Istat.it, 3 agosto 2020.
[59] Istat – Ministero della Salute, “Indagine di sieroprevalenza sul SARS-CoV-2: Tavole di dati”, Istat.it, 12 aprile 2021. https://www.istat.it/it/files//2021/04/risultati_indagine_sieroprevalenza.xlsx
[60] Morawska L. et al., “How can airborne transmission of COVID-19 indoors be minimised?”, Environment International, settembre 2020.
[61] OMS, “Coronavirus disease (COVID-19): How is it transmitted?”, World Health Organization, 13 dicembre 2020. https://www.who.int/news-room/q-a-detail/coronavirus-disease-covid-19-how-is-it-transmitted
[62] World Health Organizazion (WHO), “FACT: #COVID-19 is NOT airborne”, tweet pubblicato nell’account twitter dell’OMS, 28 marzo 2020. https://twitter.com/who/status/1243972193169616898
[63] Imbalzano G., “Nessuno deve morire”, Italia e il mondo, 4 marzo 2021.
[64] Lane J.M., “Mass Vaccination and Surveillance/Containment in the Eradication of Smallpox”, in Current Topics in Microbiology and Immunology, pp. 17–29, Springer, 2006.
[65] Zheng R. et al, “Spatial transmission of COVID-19 via public and private transportation in China”, Travel Med. Infect. Dis., aprile 2020.
[66] Fenner F. et al., “Smallpox and its eradication”, World Health Organization (WHO), 1988.
[67] Zuboff S., “Il capitalismo di sorveglianza”, Luiss University Press, 2019.
[68] O’Connell J. et al., “Contact Tracing for Covid-19 — A Digital Inoculation againstFuture Pandemics”, New England Journal of Medicine, 5 agosto 2021.
[69] Ricolfi L., “La notte delle Ninfee”, La Nave di Teseo, 2021.
[70] Garbo F., “Pingdemic: l’Immuni inglese tiene a casa migliaia di lavoratori”, agrodolce.it, 26 luglio 2021.
[71] Burgess M., “Everything you need to know about the new NHS contact tracing app”, Science, 22 ottobre 2020.
[72] Mondo A., “Covid nell’aria, la concentrazione più elevata nelle case: lo studio di Arpa Piemonte”, La Stampa, 8 gennaio 2021.
[73] Riccio I., “All’aperto, in casa, negli ospedali: la verità sul contagio del virus”, Il Giornale, 27 settembre 2021.
[74] National Cyber Security Center (NCSC), “NHS COVID-19: the new contact-tracing app from the NHS”, Portale del Governo inglese, 4 maggio 2020.
[75] Anderson R. et al., “SARS-CoV-2: Where do people acquire infection and ‘who infects whom’?”, preprint, The Royal Society, 14 dicembre 2020.
[76] AbouKorin S.A. et al., “Role of urban planning characteristics in forming pandemic resilient cities – Case study of Covid-19 impacts on European cities within England, Germany and Italy”, Cities, 27 luglio 2021.