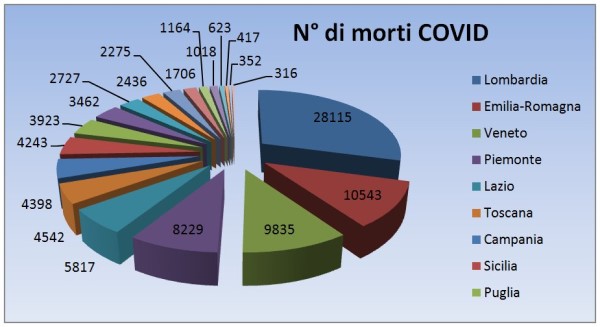
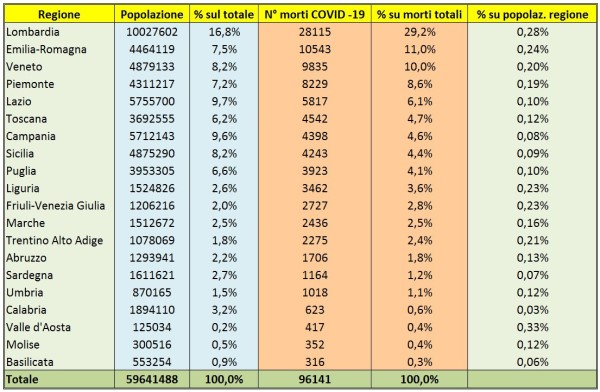
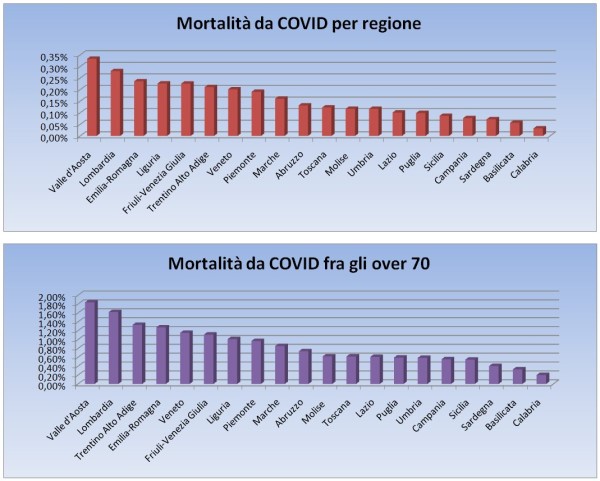
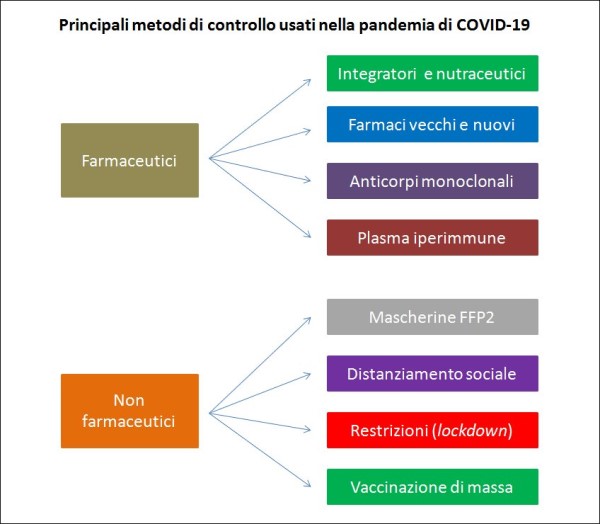
Una delle cose che mi hanno più colpito negativamente in questo anno di pandemia è stata la quasi più totale assenza – se si eccettua lo spot iniziale sull’igiene delle mani e quello sull’app Immuni – di campagne di informazione e prevenzione del Ministero della Salute attraverso il mezzo televisivo, e in particolare la mancanza di una comunicazione rivolta agli anziani, che, oltre a rappresentare la stragrande maggioranza delle vittime del COVID, sono persone che, in molti casi, si informano esclusivamente attraverso la televisione. Oltre a ciò, ho notato che vari temi rilevanti per la prevenzione del COVID non sono stati trattati tout court, neppure in trasmissioni giornalistiche e medico-scientifiche. In questo articolo affronterò, perciò, 10 fra le principali questioni che la gente a casa si è posta o trovata ad affrontare in questi mesi senza ricevere, a mio parere, delle risposte o delle indicazioni soddisfacenti.
In particolare, cercherò di fornire qui, nei limiti di una trattazione divulgativa ed al meglio delle conoscenze attuali disponibili, delle “pillole” di informazioni utili che purtroppo non sono mai state date da chi avrebbe dovuto farlo: (1) Quali sono i sintomi del COVID-19 e qual è l’evoluzione della malattia? (2) Come capire chi è davvero più a rischio di morte per il COVID-19? (3) Perché le cure domiciliari dei pazienti COVID sono fondamentali? (4) Perché il fattore tempo è così importante nella cura del COVID-19? (5) Quali integratori sono utili contro il COVID secondo la letteratura scientifica? (6) Perché la carica virale è importante nell’infezione da COVID-19? (7) Mascherine, sterilizzatori, pulsossimetri, etc.: cosa devo sapere? (8) Una domanda dei medici: come vanno trattati i pazienti a casa? (9) Come posso confrontare l’efficacia dei vari vaccini anti-COVID? (10) I vaccini anti-COVID sono sicuri o corro qualche pericolo?
1) Quali sono i sintomi del COVID-19 e qual è l’evoluzione della malattia?
Gli studi nella letteratura medica pubblicata in questo anno di pandemia riportano che i pazienti ammalati di COVID-19 possono presentare, come sintomi all’esordio: febbre, tosse secca, fame d’aria e affaticamento. Sono stati segnalati come possibili sintomi in pazienti infetti anche mal di gola, congestione nasale e naso che cola. Un numero significativo di pazienti (20%-60%) sembra avere una perdita dell’olfatto (nota anche come anosmia), che può essere il primo sintomo di presentazione [1].
Secondo quanto diffuso dai Centers for Diseases Control (CDC) di Atlanta, che negli Stati Uniti si occupano di epidemie e malattie emergenti, nei pazienti infetti sono stati segnalati anche brividi e tremore persistente, dolori muscolari, mal di testa, nonché cambiamenti nel senso del gusto. Un sintomo del contagio è talvolta la congiuntivite, per chi entra a contatto con il virus attraverso la mucosa degli occhi. Un altro disturbo che può emergere è la comparsa di vescicole sulla pelle, lesioni pruriginose e necrosi.
Nei casi più gravi, l’infezione può causare polmonite virale. Ed in circa il 90% delle diagnosi di ricovero ospedaliero di pazienti italiani morti per COVID-19 nel 2020 sono menzionate o condizioni (ad es. polmonite, insufficienza respiratoria) o sintomi (ad es. febbre, affanno, tosse) riconducibili, per l’appunto, al SARS-CoV-2 [2]. Nei ricoverati in Cina nel gennaio 2020 (relativi a 552 ospedali del Paese), la febbre era presente nel 44% dei pazienti all’ammissione, il secondo sintomo più comune era la tosse (68%), mentre nausea e vomito (5%) e diarrea (3,8%) erano poco comuni [3].
Il COVID-19 è una malattia caratterizzata da tre fasi [4], la prima delle quali è una fase virale che dura 7-10 giorni a partire dalla prima manifestazione dei sintomi. In approssimativamente il 20% dei casi è seguita da un secondo stadio – quello infiammatorio – annunciato da marcatori pro-infiammatori (ferritina, proteina C reattiva, etc.) e caratterizzato dall’apparizione di infiltrati nei polmoni, che sono seguiti in alcuni casi dal calo del livello di ossigeno nel sangue (ipossemia), rivelabile tramite un comune saturimetro.
Quest’ultima terza fase – che si verifica solo in un piccolo sottoinsieme dei pazienti iniziali (circa il 5%) – è caratterizzata da un’iperinfiammazione, che porta a una cosiddetta “tempesta citochinica” (una reazione immunitaria sistemica con cui il sistema immunitario combatte i microrganismi patogeni e induce le cellule a produrre altre citochine), che causa la “Sindrome di Distress Respiratorio Acuto” (ARDS), patologia potenzialmente fatale per la quale i polmoni non sono in grado di funzionare correttamente.
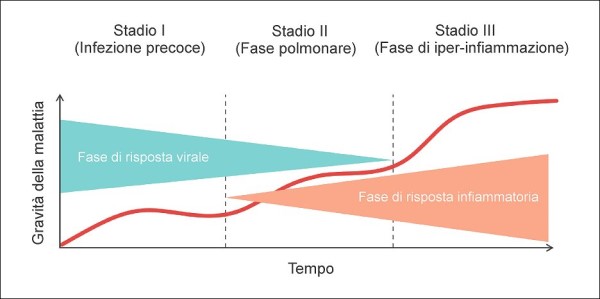
Le tre fasi della malattia COVID-19. Come vedremo, è molto importante agire già sulla prima fase, sia attraverso una prevenzione fai-da-te con opportuni integratori sia con il supporto di terapie domiciliari adeguate somministrate dai medici di base o dalle Unità Speciali di Continuità Assistenziale (USCA). Tutto ciò è ancora più determinante con la comparsa di varianti del SARS-CoV-2 più virulente.
Come spiega il prof. Giuseppe Remuzzi, direttore dell’Istituto Mario Negri, “la prima fase, quella asintomatica che dura da 3 a 5 giorni, è caratterizzata da un’alta carica virale, che aumenta ulteriormente con la comparsa dei sintomi. La malattia va quindi affrontata prima che scenda ai polmoni. Se si parte presto, di solito è possibile evitare il ricovero” [5]. È ovviamente fondamentale, allo scopo, avvertire ai primi sintomi il medico, cui spetta di indicare i farmaci da assumere e le dosi (alcuni possono avere effetti collaterali, specie se presi in concomitanza con altri).
Con la cosiddetta “variante inglese” (B.1.1.7), oggi predominante anche in Italia, la prima fase si è però ridotta a soli 2-3 giorni. Ciò suggerisce che il virus si replichi più velocemente dando meno tempo al nostro sistema immunitario per sviluppare gli anticorpi. Ma, soprattutto, secondo uno studio di Grind et al. [10], la variante inglese del SARS-CoV-2 risulta essere più letale rispetto alla variante originale, con un rischio di morte di ben il 67% maggiore, a conferma della maggior virulenza di questa variante. Come vedremo nella risposta all’ultima domanda, quest’ultimo è un effetto che potrebbe essere legato ai vaccini oggi usati.
2) Come capire chi è davvero più a rischio di morte per il COVID-19?
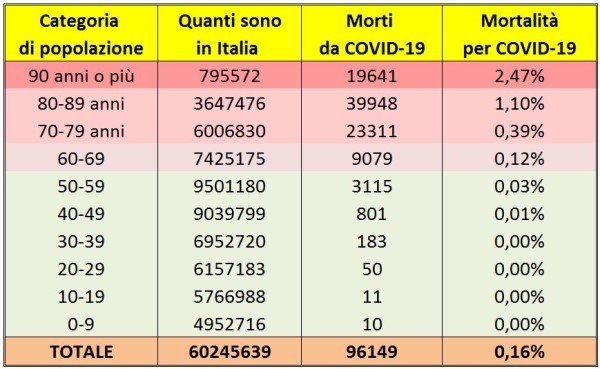
Sono ormai noti tre diversi fattori di rischio che caratterizzano un esito infausto nel COVID-19: (1) l’età, dato che ben l’85% delle vittime italiane hanno più di 70 anni (e circa il 95% delle vittime ha più di 60 anni); (2) la presenza di comorbidità (anche i pochi morti italiani sotto i 40 anni presentano, nella maggior parte dei casi, gravi patologie preesistenti: cardiovascolari, renali, psichiatriche, diabete, obesità [2]); (3) la carenza di vitamina D (nel sangue), come evidenziato da numerosi studi nel mondo [6, 7].
Si noti che, all’interno del 20% di pazienti la cui condizione, dopo la prima settimana di malattia COVID-19, può all’improvviso deteriorare si trovano anche persone che inizialmente avevano una sintomatologia lieve [4]. Di conseguenza risulta vantaggioso avere la capacità di distinguere – al di là della semplice valutazione dei fattori di rischio – i casi che avranno un andamento clinico non complicato da quelli che hanno maggiore probabilità di sviluppare distress respiratorio e che necessitano di terapie precoci.
Uno studio svolto da Cabanillas et al. [4] ha mostrato che, sebbene fra i malati di COVID-19 vi fossero differenze statisticamente significative fra i casi a basso rischio di morte e quelli a basso rischio, tuttavia non era possibile identificare uno o più fattori nella manifestazione clinica della malattia che potevano essere usati in modo affidabile per classificare i pazienti in gruppi a basso rischio o a ad alto rischio, in modo da riservare il ricovero ospedaliero soltanto a quelli del secondo gruppo e da curare a casa gli altri.
Infatti uno si aspetterebbe, intuitivamente, che la frequenza dei sintomi sia minore nei casi a basso rischio. Ma, contrariamente alle aspettative degli autori dello studio, la maggior parte dei casi seguiti – e rivelatisi a posteriori a basso rischio – presentavano, al momento della diagnosi, due o tre sintomi, il che indica come non potessero essere identificati come tali sulla base della sola sintomatologia.
Tuttavia, gli stessi autori hanno suggerito dei criteri nuovi sulla base dei quali i casi a basso rischio possono essere identificati e monitorati a casa, anche senza trattamento farmacologico (l’integrazione di vitamina D3 è comunque consigliabile anche in questi casi, dato l’elevato profilo di sicurezza nelle dosi consigliate dagli esperti a scopo preventivo: 4.000 UI al giorno, in particolare per anziani e persone “fragili” [8]), piuttosto che ricorrere all’ospedalizzazione o alla cura ambulatoriale del paziente COVID.
Il loro approccio è basato su una serie di parametri misurabili (Interleuchina-6, ferritina, D-dimero, proteina C reattiva, colesterolo HDL, linfopenia, saturazione dell’ossigeno) comprendenti essenzialmente marcatori infiammatori basati sul sangue. Questo metodo ha mostrato un’eccellente correlazione con l’esito clinico e costituisce un miglioramento rispetto al metodo del “Punteggio CALL” (che considera l’età, la presenza di comorbidità, il livello HDL e la linfopenia per assegnare un punteggio prognostico).
Infine, molte fonti di informazioni suggeriscono che in una grossa percentuale di casi la trasmissione virale avvenga in casa. Quando possibile, e in assenza di COVID hotel, gli altri contatti stretti sani dovrebbero lasciare il domicilio o quanto meno rimanere isolati in modo assai stretto. Ciò riduce la re-inoculazione del virus attraverso l’inspirazione di bioaerosol virale [9] in caso di successiva (o precedente) infezione di altri conviventi, cosa che può potenzialmente aumentare la gravità della malattia. Dunque, le persone che vivono in famiglia possono essere più a rischio rispetto a quelle che vivono da sole.
3) Perché le cure domiciliari dei pazienti COVID sono fondamentali?
Nella pandemia da COVID-19, in Italia a livello sanitario ci si è concentrati principalmente su due tipi di risposta: (1) il contenimento della diffusione dell’infezione e (2) la riduzione della mortalità dei pazienti ricoverati. Sebbene questi sforzi fossero ben giustificati, nella prima fase si sono trascurati del tutto i pazienti rimasti a casa [6], cui veniva negato l’accesso alle cure ambulatoriali del proprio medico curante. In seguito le cose non sono migliorate molto, poiché in quasi tutte le regioni le unità USCA nate allo scopo sono poche ed i loro medici sono spesso giovani con poca esperienza e iniziativa.
D’altra parte, l’attento studio dell’epidemiologia dei ricoverati suggerisce fortemente che si dovrebbe, al contrario, puntare moltissimo proprio sulle cure a domicilio dei pazienti COVID. Infatti, la maggior parte dei pazienti che arrivano ai Pronto soccorso degli ospedali con sintomi di COVID-19 non necessitano, inizialmente, di cure mediche avanzate: solo il 25% ha bisogno di ventilazione meccanica, supporto circolatorio avanzato o di terapia sostitutiva renale (per il filtraggio del sangue dei reni) [9].
Quindi, è ragionevole pensare che una buona parte – se non la maggior parte – dei ricoveri potrebbero essere tranquillamente evitati con una cura a casa dei pazienti come primo approccio, cosa che richiede il solo potenziamento dell’accesso ai farmaci ed all’ossigeno, nonché a un fondamentale dispositivo low-cost di monitoraggio come il pulsossimetro. Quest’ultimo, peraltro, potrebbe venire anche acquistato del tutto autonomamente dal paziente, se questi solo venisse meglio informato, anche con degli spot, della sua utilità, soprattutto nel rilevare forme silenti di scarsa ossigenazione del sangue (ipossemia) [11].
In altri Paesi, e anche in Italia, le cure domiciliari – per quei pochi medici che le hanno praticate e in più usando un protocollo di cura autogestito in deroga a quello stabilito dall’AIFA – hanno contribuito a trattare in sicurezza i pazienti con diversi gradi di complessità raggiungendo bassissimi tassi di ospedalizzazione e di mortalità se confrontati con quelli delle case di cura [12] oppure con quelli dei pazienti “trattati” con il protocollo dell’AIFA del 9/12/20, basato essenzialmente su un antipiretico, la tachipirina (dal prof. Remuzzi ritenuta inutile e controproducente) e sulla “vigile attesa” (come dire: aspetta e spera…).
Dunque le cure domiciliari, se fatte con protocolli opportuni, non solo (1) riducono gli accessi agli ospedali dei malati di COVID, ma anche – a cascata – (2) i ricoveri in terapia intensiva e (3) i morti, che sono i tre numeri che l’Italia non è riuscita a controllare, al punto da dover ricorrere a lockdown prolungati. Se ciò poteva forse essere tollerabile nella prima fase primaverile del 2020, quando si era del tutto impreparati, ciò non avrebbe dovuto ripetersi nell’autunno, quando c’erano tutto il tempo e il know-how necessari per spostare gran parte delle cure dalla fase tardiva ospedaliera a quella precoce domiciliare.
In Italia, alcuni medici di base di tutte le regioni si sono riuniti in un gruppo, il “Comitato per le Cure Domiciliari COVID-19”, che ha messo a punto e testato sui propri pazienti un protocollo di cura. È grazie a loro e all’efficacia dimostrata sul campo dal loro protocollo che l’Italia ha avuto un po’ meno morti di quelli che avrebbe potuto avere, dato che solo una percentuale del tutto irrisoria dei loro pazienti ha richiesto in seguito il ricovero. Tuttavia si è trattato di una goccia del mare, poiché tutti gli altri medici di base e quelli delle USCA si sono invece attenuti al protocollo ufficiale, quello dell’“aspetta e spera” [13].
Il Comitato in questione – che comprende anche uno stimato medico ospedaliero, l’oncologo Luigi Cavanna – è nato inizialmente sui social, dove è seguito da oltre 100.000 persone, e poi si è tramutato in un’associazione, la quale da tempo chiede che il proprio protocollo di cura basato sull’uso precoce di certi farmaci (quali idrossiclorochina, azitromicina, eparina, etc. e anche vitamina D) venga riconosciuto ufficialmente a seguito dell’efficacia mostrata dai numeri. Esso è in contatto con medici all’estero (Brasile, Stati Uniti, etc.) che hanno sperimentato con analogo successo protocolli molto simili.
4) Perché il fattore tempo è così importante nella cura del COVID-19?
Sebbene ora siano disponibili opzioni di cura per i pazienti con malattia COVID grave che richiedono il ricovero in ospedale, è urgentemente necessaria l’adozione di interventi che possano essere somministrati precocemente a casa durante il corso dell’infezione per prevenire la progressione della malattia e le complicanze a lungo termine [14]. I trattamenti precoci per il COVID-19, tanto più se associati a un vaccino efficace, avrebbero implicazioni rilevanti per la capacità di porre fine a questa pandemia.
Il vantaggio di curare precocemente le infezioni da agenti patogeni (e ridurre così la probabilità di ricoveri e di esiti infausti) è noto da oltre un secolo, ma per ridurre i costi e gli effetti collaterali i farmaci sono tipicamente prescritti come trattamento terapeutico, il che significa solo dopo che si sono manifestati i sintomi della malattia [15]. Inoltre, in Italia molte persone sono morte di COVID perché anche quei 2-3 giorni o più per aspettare l’esito del tampone prima di dare dei farmaci ha fatto spesso la differenza.
I medici di base del già citato “Comitato per le Cure Domiciliari COVID-19” hanno avuto successo non solo perché hanno usato un buon protocollo di cura, ma anche perché non hanno aspettato l’esito di tamponi, bensì hanno dato subito i farmaci (come del resto suggerito pubblicamente anche dal prof. Remuzzi). Chi disponeva di un ecografo portatile l’ha usato per diagnosticare la polmonite interstiziale, e l’acquisto di tale strumentazione – che è poco costosa – per medici di base e USCA sarebbe stato un investimento del Governo molto più saggio rispetto a quello per i banchi di scuola.
Lo studio sulla risposta immunitaria al COVID-19 suggerisce che un intervento precoce potrebbe aiutare a bilanciare la risposta immunitaria efficace contro l’azione dannosa causata dal SARS-CoV-2, in modo da costruire una risposta forte per combattere il virus. Poiché i pazienti con malattia moderata non hanno ancora sviluppato danni agli organi terminali, i dati suggeriscono che l’inizio del decorso della malattia è il momento migliore per intervenire con varie opzioni di trattamento per prevenire gli squilibri immunitari, proteici e metabolici osservati con la malattia più grave degli stadi successivi [16].
È proprio la fase iniziale del COVID-19, quella in cui appaiono i primi sintomi, ad essere quella più ottimale per trattare la malattia, prima che la risposta infiammatoria passi da utile a dannosa in quanto assolutamente eccessiva. In parole povere, questi risultati suggeriscono che l’intervento con vari integratori antivirali e immunomodulanti nelle prime fasi del COVID-19 (ad es. vitamina D, lattoferrina, etc.) potrebbe limitare la disfunzione nella risposta del sistema immunitario alla lotta contro il virus [16].
La cosa non è difficile da capire. Nella prima fase della malattia, assistiamo a una sorta di gara fra, da una parte, la replicazione del virus che si moltiplica creando sempre più unità di se stesso e, dall’altra, il sistema immunitario che deve produrre velocemente sempre più anticorpi per neutralizzare le particelle del virus. Gli integratori a loro volta agiscono, da una parte, rallentando la replicazione del virus (azione antivirale) e, dall’altra, favorendo la produzione di anticorpi (azione immunomodulante). Dunque, facilitano di molto il rapido prevalere dei “difensori” (gli anticorpi) rispetto agli “attaccanti” (le particelle virali).
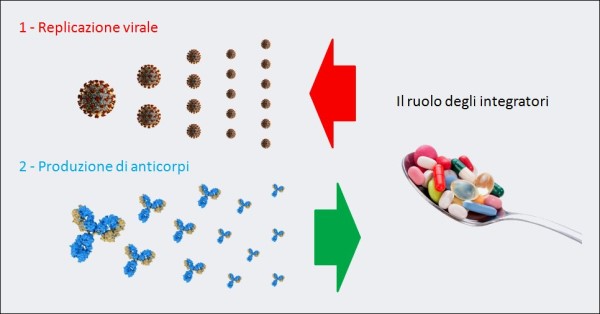
La “guerra” di un organismo contro il COVID-19 è, inizialmente, una battaglia fra la replicazione virale del SARS-CoV-2 e la produzione di anticorpi neutralizzanti queste particelle virali. Alcuni integratori (ad es. vitamina D, lattoferrina, etc.), grazie alla loro azione antivirale e immunomodulante, se presi quotidianamente come forma di prevenzione della progressione della malattia verso stadi più gravi, in caso di contagio rallentano la moltiplicazione delle particelle di virus e aiutano le difese immunitarie.
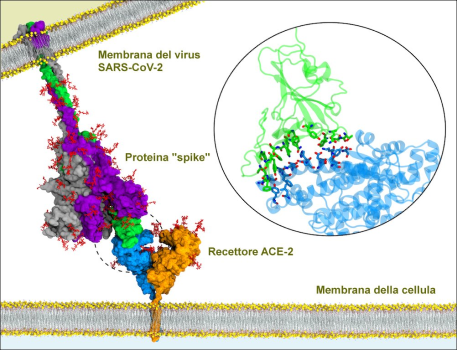
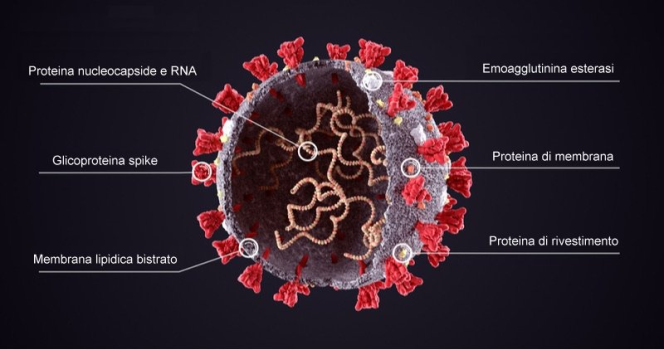
L’importanza del favorire i nostri “difensori” naturali, del resto, è palese anche con gli attuali vaccini anti-COVID, che stimolano l’organismo umano a produrre anticorpi (e una memoria immunitaria) contro la famosa proteina “spike” (una delle 26 proteine del SARS-CoV-2), che è l’uncino con cui si lega alle nostre cellule. Infatti, quando una persona viene infettata da questo virus, la risposta del sistema immunitario di un vaccinato è rapida e imponente proprio poiché “l’esercito” di anticorpi è già pronto e l’organismo non è preso alla sprovvista, come invece avviene a un non vaccinato (e non immunizzato).
5) Quali integratori sono utili contro il COVID secondo la letteratura?
La patogenesi del COVID-19 è altamente complessa e comporta la soppressione della risposta immunitaria innata e antivirale dell’ospite, l’induzione di stress ossidativo seguita da iperinfiammazione descritta come “tempesta di citochine”, che causa il danno polmonare acuto, fibrosi tissutale e polmonite [17]. Attualmente, ancora diversi farmaci sono in fase di valutazione per la loro efficacia, sicurezza e per la determinazione delle dosi per il COVID-19, ma ciò richiede molto tempo per la loro convalida.
Pertanto, esplorare la riproposizione di composti naturali contro il COVID-19 può fornire alternative sul breve termine, in quanto questi non presentano effetti collaterali e sono di basso costo e di facile reperibilità per il grande pubblico. Diversi nutraceutici hanno una comprovata capacità di potenziare il sistema immunitario e di agire come antivirali, antiossidanti e antinfiammatori. Questi includono la vitamina D, la vitamina C, la lattoferrina, lo zinco, la curcumina, i probiotici, la quercetina, etc.
Assumere alcuni di questi fitonutrienti sotto forma di integratore alimentare può dunque aiutare a rafforzare il sistema immunitario, rallentare la replicazione del virus, precludere la progressione della malattia allo stadio grave e sopprimere ulteriormente l’iperinfiammazione fornendo supporto sia profilattico che terapeutico contro il COVID-19, come sottolineato da uno studio [17] svolto da un gruppo di ricercatori indiani e pubblicato su una importante rivista di immunologia. Tra l’altro, potrebbe non essere un caso che l’India abbia avuto 10 volte meno morti COVID (per milione di abitanti) rispetto all’Italia.
La carenza di vitamina D è risultata essere, secondo svariati studi scientifici anche a livello di meta-analisi [5], un fattore di rischio indipendente per le forme gravi di COVID-19, per cui può essere usata sia in ambito preventivo (in dosi di 4.000 UI al giorno nella sua forma di vitamina D3), sia in ambito terapeutico (ad alte dosi). Pure la lattoferrina – una proteina che, come la vitamina D, ha proprietà antivirali, immunomodulanti e anti-infiammatorie – ha mostrato una notevole efficacia negli studi clinici [18, 19] nell’abbattere il rischio di forme gravi di COVID-19, e viene perciò assunta da tempo da moltissimi medici e farmacisti.
La vitamina C può potenzialmente proteggere dalle infezioni a causa del suo ruolo essenziale sulla salute immunitaria. Questa vitamina supporta la funzione di varie cellule immunitarie e migliora la loro capacità di proteggere dalle infezioni. È stato dimostrato che l’integrazione con Vitamina C riduce la durata e la gravità delle infezioni delle vie respiratorie superiori (la maggior parte delle quali si presume siano dovute a infezioni virali), compreso il comune raffreddore, che può essere prodotto da alcuni tipi di coronavirus con cui la nostra specie convive da tempo [20]. La dose raccomandata di Vitamina C varia da 1 a 3 g / giorno.
Lo zinco è un metallo essenziale coinvolto in una varietà di processi biologici grazie alla sua funzione di cofattore, molecola di segnalazione e elemento strutturale. Regola l’attività infiammatoria e ha funzioni antivirali e antiossidanti. Lo zinco è considerato il potenziale trattamento di supporto contro l’infezione da COVID-19 a causa dei suoi effetti antinfiammatori, antiossidanti e antivirali diretti. Quest’ultimo effetto è ottenuto riducendo l’attività dell’ACE-2, la proteina delle cellule a cui l’uncino (spike) del SARS-CoV-2 si lega per entrare nella cellula [17]. La dose raccomandata da vari studi varia da 20 a 92 mg / settimana.
La curcumina, che possiamo assumere aggiungendo un cucchiaino di curcuma al cibo, ha un ampio spettro di azioni biologiche, comprese attività antibatteriche, antivirali, antimicotiche, antiossidanti e antinfiammatorie [21]. Inoltre inibisce la produzione di citochine pro-infiammatorie nelle cellule, ed esercita un effetto antivirale su un’ampia gamma di virus, tra cui virus dell’influenza, adenovirus, epatite, virus del papilloma umano (HPV), virus dell’immunodeficienza umana (HIV), etc. [22]. Pertanto, la curcumina potrebbe essere un altro integratore interessante nella lotta alla patogenesi del COVID-19.
6) Perché la carica virale è importante nell’infezione da COVID-19?
Come per qualsiasi altro agente patogeno (batteri, funghi, etc.) o veleno, i virus sono di solito più pericolosi quando si presentano in quantità maggiori. Sola dosis venenum facit, ovvero “è la dose che fa il veleno”, dicevano i latini e il concetto si applica, mutatis mutandis, anche ai virus. “Piccole esposizioni iniziali tendono a portare a infezioni lievi o asintomatiche, mentre dosi più grandi possono risultare letali”, come ha spiegato molto bene il professore di chimica e genomica Joshua Rabinovitz.
Lo sappiamo bene nel caso dei batteri, in quanto è proprio la concentrazione di noti batteri indicatori di contaminazione fecale – l’Escherichia coli e gli enteroccchi intestinali – a definire se un’acqua costiera è balneabile o meno. Ad es., il valore limite dei primi è di 500 UFC (Unità Formanti Colonie) / 100 ml di acqua. Oltre questa soglia la balneazione è vietata, poiché alcuni ceppi di questi batteri possono causare nell’uomo infezioni a carico del tratto digerente, delle vie urinarie o di molte altre parti del corpo.
La cosiddetta “carica virale” è invece un’espressione numerica della quantità di virus in un dato volume di fluido corporeo (ad es. l’espettorato, il plasma sanguigno, etc.). Ogni virus ha la capacità di sopravvivere per un certo tempo nell’ambiente all’interno del fluido, ma è necessaria una carica virale minima per produrre l’infezione negli esseri umani: ad es. sono sufficienti circa 100 particelle virali nel caso del norovirus [23] – il virus a RNA responsabile della diarrea – e tale quantità minima è diversa da virus a virus.
Pertanto, per proteggersi dal COVID-19, occorre cercare di prevenire l’esposizione ad alte dosi di virus. In pratica, entrare in un palazzo di uffici in cui qualcuno è stato con il coronavirus non è così pericoloso come sedersi accanto a quella persona per un’ora in treno. Perciò, la durata breve dell’esposizione – così come il distanziamento sociale e una corretta igiene – aiutano a ridurre la dose di virus che possiamo inalare. Anche le mascherine FFP2 possono contribuire ad abbattere di molto la dose in questione.
L’esposizione ad alte dosi di SARS-CoV-2 è più probabile nelle interazioni ravvicinate fra le persone, come nel corso di riunioni o in bar affollati, o nel toccarsi il naso o la bocca dopo aver ricevuto quantità sostanziose di virus sulle mani. Le ricerche hanno mostrato che le interazioni interpersonali sono più pericolose in spazi chiusi e a breve distanza, con un’escalation nelle dosi che aumenta con il tempo di esposizione. Quest’ultimo rappresenta quindi una variabile molto interessante.
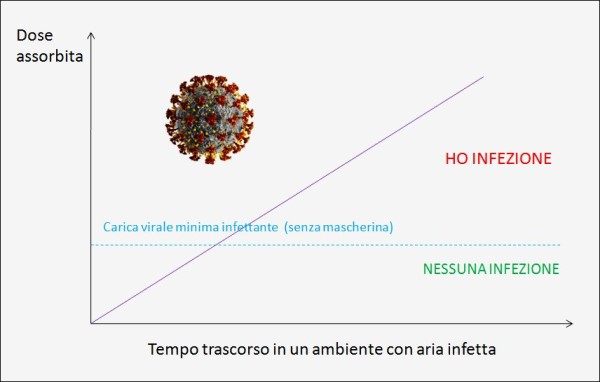
Più tempo si trascorre in un ambiente chiuso o semichiuso con aria infetta dal virus e maggiori sono le probabilità di infettarsi, a parità di altre condizioni. L’uso della mascherina, se questa è scelta e indossata correttamente, può abbattere quindi di molto la probabilità di contagio e, quando anche quest’ultimo si verificasse, la barriera costituita dalla mascherina permette di assorbire una carica virale inferiore.
Un esperimento effettuato dall’Istituto per le Malattie infettive americano (NIAD) [24] ha mostrato come il virus SARS-CoV-2 possa rimanere sospeso nell’aria, sotto forma di aerosol, fino a 3 ore. Tuttavia, la quantità di virus si dimezza nel giro di un’ora ed è bassa negli spazi aperti. Pertanto, la minaccia di contagio può arrivare soprattutto dai luoghi chiusi (o semi-chiusi) e affollati, con i mezzi di trasporto (metropolitane, autobus, tram, treni locali, etc.) a farla da padrone per l’elevata densità di persone associata.
Una volta capito il concetto di carica virale, si può comprendere facilmente perché il COVID-19 ha spesso sterminato intere famiglie: in Cina come in Italia e in altri Paesi sono state innumerevoli le famiglie i cui membri si sono tutti ammalati e sono morti uno dopo l’altro in casa (per la saturazione degli ospedali e per la mancanza dei cosiddetti “COVID hotel”). Infatti, il non usare le mascherine in famiglia e il non isolare subito i contagiati espone gli altri familiari a dosi di virus assai elevate, donde gli esiti infausti.
7) Mascherine, sterilizzatori, pulsossimetri, etc.: cosa devo sapere?
Secondo uno studio anticipato dal The New England Journal of Medicine [25], la carica virale del SARS-CoV-2 rilevata nei pazienti COVID asintomatici era simile a quella dei sintomatici, il che dà un’idea quantitativa del potenziale di trasmissione dei soggetti asintomatici o minimamente sintomatici rispetto ai sintomatici. Dato che non possiamo sapere se siamo nei pressi di un soggetto asintomatico o paucisintomatico che potrebbe trasmetterci l’infezione, l’indossare una mascherina di protezione è fondamentale.
La mascherina non serve solo a impedire l’infezione, ma anche a ridurre la carica virale cui potremmo essere esposti. Oltre all’utilità nella protezione individuale, l’uso di massa delle mascherine può ridurre di molto la trasmissione dei virus respiratori. Ad es., secondo uno studio di Wu et al. [26], durante l’epidemia di SARS del 2003 l’abbattimento della trasmissione virale è stato addirittura del 70%. E, sempre grazie all’uso delle mascherine, nell’inverno 2002-2003 a Hong Kong l’influenza di fatto non circolò.
Esistono, come è noto, tre diversi tipi di mascherine di tipo medico: (1) chirurgiche (di forma rettangolare, sono inadatte a un filtraggio superiore al 65%, non essendo aderenti al viso); (2) respiratorie di tipo FFP2 (o N95), che filtrano almeno il 95% delle particelle di 0,6 micron o più grandi; (3) respiratorie di tipo FFP3 (o N99), che filtrano almeno il 99% delle particelle di 0,6 micron o più grandi. Queste ultime, però, se espellono l’aria della persona tramite una valvola non proteggono le altre persone (sono perciò dette “egoiste” e non devono mai essere usate per la protezione dal SARS-CoV-2).
Poiché le nuove varianti attecchiscono molto più facilmente, è senza dubbio raccomandabile l’utilizzo di mascherine FFP2, ma è importante accertarsi che siano prodotte in Italia e che forniscano una certificazione rilasciata da un ente del settore. Oggi le si possono trovare facilmente digitando nei siti di commercio elettronico “mascherine ffp2 italiane certificate”. Ovviamente, vanno poi indossate bene adattando l’archetto metallico alla forma del proprio naso. Una FFP2 è garantita per un uso di almeno 8 ore, ma se la usate solo negli ambienti chiusi (e all’esterno usate una chirurgica) di solito dura di più.
Le mascherine e le superfici possono essere sterilizzate in modo assai efficace con una soluzione idroalcolica al 70%, come illustrato in un mio articolo sull’argomento [3]. Gli ambienti, invece, possono essere sterilizzati facilmente usando lampade germicide a raggi UV-C, che vanno usate sempre solo in assoluta assenza di persone, poiché i raggi UV-C sono cancerogeni per la pelle e molto pericolosi per gli occhi. Per sterilizzare una grande stanza in 10 minuti, servono circa 5 W di UV-C [4]. Sconsiglio invece l’uso di ozonizzatori, perché potrebbero operare nella regione “tossica” per i polmoni.
Consiglio inoltre di avere a casa un saturimetro, detto anche pulsossimetro (tenetevi invece alla larga dalle app per misurare l’ossigeno). I modelli con il miglior rapporto qualità / prezzo sono quelli marchiati GIMA, usati anche dagli equipaggi delle ambulanze, mentre eviterei quelli cinesi low-cost, quasi del tutto inutili. Un normale livello di ossigeno nel sangue (SpO2), per polmoni sani, è compreso in genere fra il 95% ed il 100%. In generale, una lettura del saturimetro inferiore al 95% è considerata bassa. Pertanto, già al di sotto di questa soglia – specie se il trend è decrescente – andrebbe avvisato il medico.
Nel caso ci si dovesse mai trovare in una situazione come quella verificatasi nella primavera del 2020 – con gli ospedali pieni e le persone malate di COVID che si dovevano curare a casa da sole, ma il loro numero era tale che c’era scarsità di bombole di ossigeno – è bene sapere che, in assoluta mancanza di alternative, per una persona che ha difficoltà nel respirare si può usare, in associazione a una maschera per ossigenoterapia, un concentratore di ossigeno, che lo produce da solo per cui il gas non si esaurisce mai. Ormai ne esistono sul mercato vari modelli, ed i migliori producono 6-8 litri al minuto [4].
8) Una domanda dei medici: come vanno trattati i pazienti a casa?
Come in tutte le aree della medicina, anche per le cure domiciliari il grande studio clinico “randomizzato, controllato con placebo, a gruppi paralleli in pazienti appropriati a rischio con esiti significativi” rappresenta il gold standard teorico per raccomandare la terapia. Questi standard, però, non sono abbastanza rapidi o rispondenti alla pandemia COVID-19 [9], in quanto seguire i pazienti a casa per uno studio controllato rappresenta uno sforzo organizzativo ed economico molto grande da affrontare.
Se gli studi clinici controllati sui pazienti a casa non sono facili, è evidentemente necessario esaminare altre informazioni scientifiche relative all’efficacia e alla sicurezza dei farmaci. Pertanto, nel contesto delle attuali conoscenze, data la gravità della malattia e la relativa disponibilità, costo e tossicità delle terapie, ogni medico e paziente devono fare una scelta: vigile attesa passiva in auto-quarantena o trattamento attivo più o meno “empirico” allo scopo di ridurre le probabilità ospedalizzazione e la morte [9], ad es. sfruttando il protocollo dei colleghi medici di base del già citato “Comitato per le Cure Domiciliari COVID-19”.
Quest’ultimo si basa principalmente sull’idrossiclorochina in associazione con l’azitromicina, nonché sull’eparina e altri farmaci, secondo lo schema molto dettagliato pubblicato in uno studio di McCoullogh et al. [9], coordinato dall’epidemiologo statunitense Harvey Risch. Uno studio condotto in Francia su pazienti ricoverati e positivi al SARS-CoV-2, e confermato da uno successivo più ampio, ha in effetti evidenziato che l’aggiunta di azitromicina all’idrossiclorochina ha determinato una riduzione della carica virale e un significativo miglioramento del decorso della patologia [29].
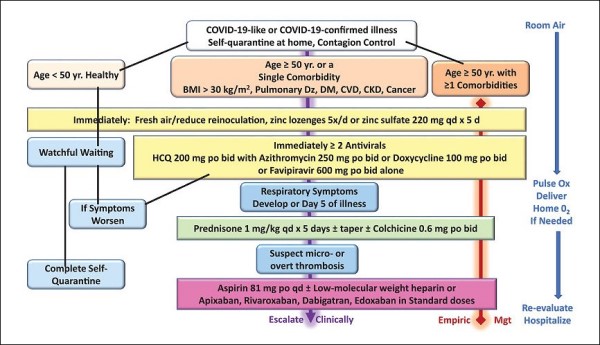
Algoritmo di trattamento per la malattia COVID-19 confermata in pazienti ambulatoriali a casa in quarantena automatica. BMI = indice di massa corporea; CKD = malattia renale cronica; CVD = malattia cardiovascolare; DM = diabete mellito; Dz = malattia; HCQ = idrossiclorochina; Mgt = gestione; O2 = ossigeno; Ox = ossimetria; Yr = anno. (fonte: McCoullogh et al. [9])
L’infezione da SARS-CoV-2, come molte altre, può essere più suscettibile di terapia nelle prime fasi del suo corso, ma probabilmente non risponde agli stessi trattamenti molto tardi nelle fasi ospedaliere e terminali della malattia. Perciò, è necessario iniziare il trattamento prima che i risultati di tamponi PCR siano noti. Inoltre, poiché il COVID-19 esprime un ampio spettro di malattie che progrediscono dall’infezione asintomatica a quella sintomatica fino alla fulminante sindrome da distress respiratorio e al cedimento del sistema multiorgano, è necessario personalizzare la terapia [9].
L’estensione a livello nazionale del protocollo adottato di recente dal Piemonte, mutuato dall’esperienza del“Comitato per le Cure Domiciliari” (e basato sull’impiego della vitamina D della idrossiclorochina, etc.) – e che pare aver dato risultati notevoli, sebbene non pubblicati per le ragioni di cui sopra – sarebbe forse preferibile rispetto all’adozione di linee guida “teoriche” (come quelle proposte da Remuzzi [30], da Matteo Bassetti, etc.), che si basano su studi di farmaci testati in fasi di cura del COVID più avanzate, ma non ancora in fase precoce con studi controllati (tuttavia uno studio sull’approccio Remuzzi è in corso).
In ogni caso, perfino uno di questi ipotetici protocolli “sintetici”, teorici, non ancora validati in fase precoce rappresenterebbe, quasi certamente, un notevole “upgrade” rispetto alle indicazioni terapeutiche fornite a novembre dal Ministero della Salute nella circolare dal titolo “Gestione domiciliare dei pazienti con infezione da SARS-CoV-2” [31], basata sulle raccomandazioni dell’AIFA (e sospesa dal TAR del Lazio il 4/3/21). In base a tale documento, si possono usare antinfiammatori come paracetamolo (ad es. Tachipirina) o FANS per pazienti sintomatici, in particolare in caso di febbre, dolori articolari o muscolari.
Il testo dichiara, inoltre, che “l’uso dei corticosteroidi è raccomandato nei soggetti con malattia COVID-19 grave che necessitano di supplementazione di ossigeno”. Invece, l’eparina è indicata solo nei soggetti immobilizzati per l’infezione in atto. Al medico, infine, la circolare suggerisce di avere un approccio di “vigile attesa” con “misurazione periodica della saturazione dell’ossigeno” tramite il saturimetro. Nel documento si suggerisce poi di monitorare i parametri vitali tramite un punteggio: quello consigliato è il “Modified Early Warning Score”. Ma quanti medici di base hanno l’hanno davvero calcolato?
9) Come posso confrontare l’efficacia dei vari vaccini anti-COVID?
Nel valutare i vaccini, in realtà, si usano due diversi tipi di indicatori – l’efficacia e l’efficienza – e poiché i media non spiegano mai la differenza fra i due, è facile che nei lettori si ingeneri una grande confusione, poiché non si può confrontare ad es. l’efficacia di un vaccino X con l’efficienza di un vaccino Y, poiché sarebbe un po’ come confrontare le mele con le pere: semplicemente non ha senso. Inoltre, quella che ci interessa da un punto di vista pratico è più l’efficienza che non l’efficacia.
La cosiddetta “efficacia” (efficacy) di un vaccino è la percentuale di riduzione dell’incidenza della malattia in un gruppo vaccinato rispetto a un gruppo non vaccinato in condizioni ottimali. La cosiddetta “efficienza” (effectiveness) del vaccino, invece, è la capacità del vaccino nel prevenire esiti di interesse per il “mondo reale” [2]. La seconda dà una valutazione meno rigorosa (anche perché non è ottenuta attraverso uno studio controllato randomizzato su un campione prescelto) ma più rilevante dal punto di vista sanitario.
In termini statistici, l’efficacia è un’unità di misura che definisce quanto un vaccino riduce il rischio di contrarre una malattia, come ad esempio il COVID-19. In pratica, nei trial si osserva quante persone vaccinate con il vaccino in esame hanno contratto il SARS-COV-2 e si compara questo dato con quante persone (che hanno ricevuto soltanto il placebo) si sono ammalate. La differenza risulta nella percentuale di efficacia dichiarata dai produttori (ad es. 95% per il Pfizer contro la variante originale del virus).
Zero efficacia significa che i vaccinati corrono lo stesso rischio delle persone che non hanno ricevuto il vaccino. Un’efficacia del 100% vuol dire che il rischio di contrarre la malattia è risultato azzerato. Solitamente, però, l’efficacia varia a seconda del Paese in cui viene effettuato lo studio. Ad esempio, le sperimentazioni dei vaccini anti-COVID in genere mostrano un’efficacia più bassa in Sudafrica o in Sud America, dove sono largamente presenti due varianti verosimilmente indotte dai vaccini stessi [32].
L’efficienza di un vaccino, invece, è la sua capacità di ridurre esiti spiacevoli per la persona o per il sistema sanitario, che nel caso del COVID-19 sono, essenzialmente tre: (1) l’ospedalizzazione in reparti a bassa intensità di cura; (2) il ricovero nel reparto di terapia intensiva; (3) la morte del paziente. Da questo punto di vista, ad esempio, il vaccino Pfizer con cui in Israele si è vaccinato oltre il 95% della popolazione ha mostrato di avere una capacità assai elevata di prevenire tutti e tre questi esiti.
Dunque, per poter confrontare i vari vaccini anti-COVID, in realtà conoscere la sola efficacia risultante dai trial (in cui il vaccino è somministrato a un campione di persone sane selezionate ad hoc) risulta utile fino a un certo punto. Una volta che il vaccino viene impiegato sul campo per la vaccinazione di massa, è l’efficienza il dato che dobbiamo valutare e confrontare, anche se la somministrazione a una popolazione non selezionata può introdurre dei bias, e quindi i dati ottenibili sono meno “solidi”.
Dai dati disponibili finora, i vaccini attualmente usati in Italia (Pfizer, Moderna e Astrazeneca) mostrano tutti una buona efficienza contro la variante inglese (B.1.1.7), che dunque non è resistente agli anticorpi neutralizzanti da essi indotti. Al contrario, la variante sudafricana (B.1.351) pone maggiori problemi, non tanto per i vaccini a mRNA (Pfizer e Moderna), quanto per Astrazeneca, i cui anticorpi neutralizzanti hanno mostrato un’attività molto bassa contro questa variante, un serio segnale di allarme sui problemi che i virus resistenti possono porre nel prossimo futuro [33].
10) I vaccini anti-COVID sono sicuri o corro qualche pericolo?
La sicurezza di un vaccino dipende dai suoi effetti collaterali. Questi possono essere divisi, essenzialmente, in tre diversi tipi: (1) effetti a breve termine (minuti, ore, pochi giorni), (2) effetti a medio termine (settimane, mesi), e (3) effetti a lungo termine (anni). In un vaccino normale vengono studiati tutti e tre i tipi di effetti, ma nel caso dei vaccini anti-COVID – sviluppati frettolosamente per uso “in emergenza”: (a) gli effetti a lungo termine non sono stati studiati; (b) si tratta, fondamentalmente, di vaccini “leaky” (vedi [32]), il che può comportare una serie di conseguenze imprevedibili sul medio termine.
Ma vediamo le cose più in dettaglio. Gli effetti a breve termine dei vaccini anti-COVID attualmente in commercio in Italia (Pfizer, Moderna, Astrazeneca) non pongono particolare motivo di preoccupazione, se non forse per le donne incinte, per chi avesse un’infezione COVID in corso (altra circostanza non testata nei trial, per cui potrebbe essere prudente realizzare un test antigenico prima del vaccino), e – verosimilmente – per la popolazione più giovane. Infatti, come ora vedremo, il rapporto rischi/benefici sembra invertirsi al di sotto di una certa età, sebbene non esistano dati diretti sull’argomento.
Grazie al database USA degli effetti avversi (VAERS), l’ing. A. Tsiang ha stimato [34], in modo semplice ed elegante, che le morti per milione di dosi somministrate associate ai vaccini Pfizer + Moderna sono state circa 100 volte maggiori di quelle segnalate per la vaccinazione antinfluenzale 2019-20 (vedi l’Appendice qui sotto). In pratica, le morti imputabili a questi due vaccini anti-COVID sono pochissime: solo 23 per milione di dosi (in ottimo accordo con i 21,2 e 28,3 morti/milione segnalati, rispettivamente, per Pfizer e Astrazeneca nel database del Regno Unito (MHRA) [35]. Ciò significa che il rischio di morire per il vaccino uguaglia quello di morire per COVID-19 per i ragazzi di circa 25 anni (vedi Appendice).
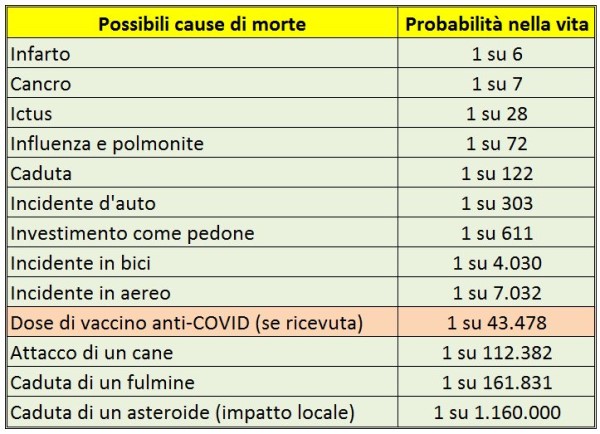
Il rischio di morire per una dose di vaccino anti-COVID posto nella giusta prospettiva. Anche considerando un numero di dosi ricevute di vaccino anti-COVID pari a 2 o 3, si tratta comunque di un rischio di morte statisticamente molto basso rispetto ad altri cui siamo esposti comunemente nel corso della nostra vita. (fonte degli altri rischi: U.S. National Safety Council – Center for Health Statistics)
Per quanto riguarda invece gli effetti a medio termine dei vaccini anti-COVID in commercio, attualmente non si conosce la loro incidenza (ad es. quella di complicazioni tromboemboliche o di eventuali risposte infiammatorie che portino a condizioni autoimmuni) a molte settimane dalla dose ricevuta (quando tali eventi vengono più difficilmente inseriti nei database degli affetti avversi) e tanto meno conosciamo gli effetti di tali vaccini quando l’immunità tende a svanire, verosimilmente dopo molti mesi. Inoltre, prima o poi potrebbero emergere nuove varianti del virus che “bypasseranno” del tutto i vaccini attuali e/o saranno più virulente e pericolose per la popolazione, come ho illustrato con vari esempi storici qui [32].
Il virologo e grande esperto di vaccini Geert Vanden Bossche (che ha lavorato per OMS, FDA, CDC, GAVI, Bill e Melinda Gates Foundation, etc.) è assai preoccupato: fare una vaccinazione di massa a pandemia in corso, con vaccini “non sterilizzanti” (come quelli ora usati [32]) ha un’altra importante conseguenza: la soppressione temporanea del baluardo contro questo virus costituito dall’immunità naturale “innata”, cosa assai problematica (specie fra i più giovani), poiché prima o poi la pressione evolutiva esercitata dai vaccini può selezionare ceppi mutanti di SARS-CoV-2 resistenti ai vaccini – come sta già accadendo con la resistenza agli antibiotici – rendendo addirittura controproducente l’immunità artificiale indotta dagli attuali vaccini, che è solo “proteina spike-specifica” [36, 37].
Infine, normalmente il processo per approvare un nuovo vaccino richiede un decennio, così da poter escludere effetti a lungo termine. La durata troppo breve degli studi fatti per ottenere le autorizzazioni “in emergenza” dalle autorità regolatorie (FDA, EMA, etc.) – la FDA ad es. richiede solo 2 mesi di dati raccolti – non consente una stima realistica degli effetti tardivi. Ad esempio, per i vaccini a mRNA (mai usati prima!) non è stato studiato l’impatto sulla fertilità e l’eventuale trasmissione alla progenie di mutazioni dannose e, per quelli a vettore virale, l’eventuale cancerogenesi. Non a caso, a chi fa il vaccino anti-COVID in Italia viene fatto firmare un modulo di consenso informato che nell’allegato recita “non è possibile al momento prevedere danni a lunga distanza”.
In conclusione, poiché i vaccini devono essere somministrati solo se i benefici superano i rischi, in considerazione: (1) di quanto fin qui illustrato, (2) del fatto che i vaccini “leaky” non producono immunità di gregge, e (3) tenendo conto del fatto che circa il 96% dei morti per COVID in Italia sono costituiti da over 60 [38] (più alcuni individui fragili), a mio avviso si dovrebbe vaccinare solo la popolazione a rischio – appunto, over 60 e persone “fragili” di ogni classe di età (ad es. immunodepressi, etc.), come del resto avviene da sempre per la vaccinazione contro i virus dell’influenza – senza far correre alla popolazione più giovane anche i rischi sul medio e lungo termine, oggi del tutto imprevedibili per dei vaccini sperimentali.
APPENDICE – Stima della mortalità legata ai vaccini anti-COVID negli USA
L’ing. A. Tsiang dell’Environmental Health Trust (EHS) statunitense, ispirato da un articolo apparso sulla testata The Epoch Times [39], ha stimato i tassi di mortalità legati ai due vaccini anti-COVID usati negli USA (Pfizer e Moderna) tramite un attento confronto, possibile grazie al database pubblico VAERS, con i tassi di mortalità riscontrati nella vaccinazione antinfluenzale 2019-20, che sono risultati essere di circa 100 volte più bassi. Infatti, se le morti segnalate come affetti avversi dei vaccini anti-COVID fossero per la maggior parte casuali, logicamente dovrebbero essere simili (in percentuale sulle dosi somministrate) a quelle segnalate per l’influenza, e non due ordini di grandezza più grandi. Ma ecco quanto ha trovato.
Poiché i morti negli USA segnalati al VAERS nella campagna antinfluenzale 2019-2020 sono stati circa 45 su 170 milioni di vaccinati, l’incidenza è stata dello 0,000026%, pari a circa 0,26 morti per milione di dosi. Viceversa, poiché i morti segnalati in relazione ai vaccini anti-COVID negli USA sono stati, dal 14 dicembre 2020 al 19 febbraio 2021 (circa 2 mesi), 966 su 41.977.401 dosi somministrate, l’incidenza è stata dello 0,0023%, pari a circa 23,0 casi per milione di dosi. Dunque, i morti in eccesso prodotti dai 2 vaccini anti-COVID Pfizer + Moderna sono stimabili in (23,0 – 0,26 =) 23 morti per milione di dosi somministrate. Siamo quindi ora in grado di stimare il rapporto rischi-benefici per le varie classi di età.
Si noti che il tasso di mortalità da infezione COVID negli USA è stato, secondo i CDC di Atlanta, dello 0,003% per la fascia di età 0-19 anni, e dello 0,02% per la fascia di età 20-49 anni. Quindi il rapporto rischi-benefici nel fare questi due vaccini sembra essere maggiore solo per le persone di età, verosimilmente, maggiori di circa 25 anni. Per le persone più giovani di (all’incirca) questa età, il rischio di morire per il vaccino o per il COVID-19 sembra essere dunque praticamente equivalente, e ciò dovrebbe essere un aspetto da valutare con attenzione in una seria politica di salute pubblica, anche in considerazione del fatto che poco o nulla si sa sui possibili effetti a medio o a lungo termine dei vaccini a mRNA (mai usati prima sull’uomo).
Vorrei sottolineare che questo risultato si può considerare molto “solido”, poiché:
- La platea dei vaccinati per l’antinfluenzale è composta per lo più da anziani, quindi in realtà se si facessero le correzioni per età il rapporto in questione (100 x) risulterebbe ancora più grande.
- Entrambe le vaccinazioni sono state fatte a una platea di persone vastissima (decine di milioni di persone), perciò l’errore statistico risulta essere del tutto ininfluente.
- Vi è un ottimo accordo con i dati ottenuti per il Regno Unito dal database MHRA [35] e con quelli ottenibili, sia pure indirettamente, per l’Italia (ciò sarà mostrato in un futuro articolo).
- Secondo l’ultimo rapporto dell’AIFA, il numero di segnalazioni (per 100.000 dosi) degli effetti avversi dei vaccini anti-COVID appare essere maggiore per le classi di età più giovani [40].
Riferimenti bibliografici
[1] Zahra S.A. et al, “Can symptoms of anosmia and dysgeusia be diagnostic for COVID‐19?”, Brain and Behaviour, Settembre 2020.
[2] Istituto Superiore di Sanità, “Caratteristiche dei pazienti deceduti positivi all’infezione da SARS-CoV-2 in Italia”, Epicentro, Dicembre 2020.
[3] Guan W. et al., “Clinical Characteristics of Coronavirus Disease 2019 in China”, The New England Journal of Medicine, Febbraio 2020.
[4] Cabanillas F. et al., “Home-based management of COVID-19”, preprint, MedRxiv, Gennaio 2021.
[5] Palazzo S., “Ecco come curare il Covid a casa”/ Il documento di Remuzzi: “Così evitiamo ricoveri”, Il Sussidiario, 14 dicembre 2020.
[6] Menichella M., “Vitamina D e minore mortalità per COVID-19: le evidenze e il suo uso per prevenzione e cura”, Fondazione David Hume, 23 febbraio 2021.
[7] Infante M. et al., “Low Vitamin D Status at Admission as a Risk Factor for Poor Survival in Hospitalized Patients With COVID-19: An Italian Retrospective Study”, J. Am. Coll. Nutr., Febbraio 2021.
[8] Isaia G., D’Avolio A., e altri 155 medici italiani, appello promosso dall’Accademia di Medicina di Torino, “Vitamina D nella prevenzione e nel trattamento del COVID-19: nuove evidenze”, Medico e paziente, 3 dicembre 2020.
[9] McCullough P.A. et al., “Rationale for early outpatient covid-19”, American Journal of Medicine, Gennaio 2021.
[10] Grind D. et al., “Case fatality risk of the SARS-CoV-2 variant of concern B.1.1.7 in England, preprint, medRxiv, 8 marzo 2021.
[11] Luks A.M. et al., “Pulse Oximetry for Monitoring Patients with COVID-19 at Home. Potential Pitfalls and Practical Guidance”, Ann. Am. Thorac. Soc., Settembre 2020.
[12] Gaspar H.A. et al., “Home Care as a safe alternative during the COVID-19 crisis”, Rev. Assoc. Med. Bras., Novembre 2020.
[13] Ferro A., “Ecco la terapia italiana anti-Covid che il Governo non prende in considerazione”, Il Giornale, 10 febbraio 2021.
[14] Kim P.S. et al., “Therapy for Early COVID-19: A Critical Need”, JAMA, Novembre 2020.
[15] Kennedy D.A. et al., “Why does drug resistance readily evolve but vaccine resistance does not?”, Proc. R. Society Biology, Marzo 2017.
[16] Su Y. et al., “Multi-Omics Resolves a Sharp Disease-State Shift between Mild and Moderate COVID-19”, Cell, Dicembre 2020.
[17] Mrityunjaya M. et al., “Immune-Boosting, Antioxidant and Anti-inflammatory Food Supplements Targeting Pathogenesis of COVID-19”, Front. Immunol., Ottobre 2020.
[18] Guan W.J. et al., “Clinical characteristics of coronavirus disease 2019 in China”, New England Journal of Medicine, 2020.
[19] Li Q. et al., “Early transmission dynamics in Wuhan, China, of novel coronavirus–infected pneumonia”, New England Journal of Medicine, 2020.
[20] Van Driel M.L. et al., “Oral vitamin C supplements to prevent and treat acute upper respiratory tract infections”, Cochrane Database Syst Rev., 2019.
[21] Catanzaro M. et al., “Immunomodulators inspired by nature: a review on curcumin and Echinacea”, Molecules, 2018.
[22] Chen T.Y. et al., “Inhibition of enveloped viruses infectivity by curcumin”, PLoS ONE, 2013.
[23] Robilotti, E. et al., “Norovirus”, Clinical Microbiology Reviews, 2015.
[24] Doremalen N. et al., “Aerosol and Surface Stability of SARS-CoV-2 as Compared with SARS-CoV-1”, Letter, The New England Journal of Medicine, Aprile 2020.
[25] Zou L. et al., “SARS-CoV-2 Viral Load in Upper Respiratory Specimens of Infected Patients”, Letter, The New England Journal of Medicine, Marzo 2020.
[26] Wu J. et al., “Risk Factors for SARS among Persons without Known Contact with SARS Patients, Beijing, China”, Emerging Infectious Diseases, 2004.
[27] Menichella M., “Come sterilizzare e ‘riciclare’ una mascherina”, Esperimentanda, 2020.
[28] Cicala L., “Coronavirus – Concentratori di ossigeno”, Theremino, 2020.
[29] Gautret P. et al., “Hydroxychloroquine and azithromycin as a treatment of COVID-19: results of an open-label non-randomized clinical trial”, Int. J. Antimicrob. Agents, 2020.
[30] Perico N. et al., “A recurrent question from a primary care physician: How should I treat my COVID-19 patients at home?”, Clinical and Medical Investigations, Novembre 2020.
[31] Direzione Generale della Programmazione sanitaria, “Gestione domiciliare dei pazienti con infezione da SARS-CoV-2”, Portale web del Ministero della Salute, 30 novembre 2020.
[32] Menichella M., “I vaccini anti-COVID: perché ci attende un future pieno di incognite”, Fondazione David Hume, 10 marzo 2021.
[33] Moore J.P., “Approaches for Optimal Use of Different COVID-19 Vaccines Issues of Viral Variants and Vaccine Efficacy”, JAMA, 4 marzo 2021.
[34] Tsiang A. (Environmental Health Trust, USA), “200X Higher Overall Deaths after COVID-19 vs. Flu vaccines”, Comunicazione tramite mailing list, 11 marzo 2021.
[35] Ricolfi L., Analisi dei dati del database MHRA degli effetti avversi nel Regno Unito (per un articolo in preparazione), Comunicazione personale, 19 marzo 2021.
[36] Vanden Bossche G., “Mass Vaccination in a Pandemic – Benefits versus Risks”, Intervista effettuata dal Dr. Philip McMillan, YouTube, 6 marzo 2021.
[37] Vanden Bossche G., “Public Health Emergency of International Concern”, appello indirizzato alle principali Autorità sanitarie di tutto il mondo, Agenzia Stampa Italia, 2020.
[38] Menichella M., “Perché la vaccinazione degli anziani va maneggiata con cura: un’analisi per scenari”, Fondazione David Hume, 4 febbraio 2021.
[39] Farber C., “Adverse incident reports show 966 deaths following vaccination for COVID-19”, The Epoch Times, Febbraio 2021.
[40] Agenzia Italiana del Farmaco, “Secondo Rapporto sulla sorveglianza dei vaccini COVID-19 (27/12/2020 – 26/2/2021)”, Sito web dell’AIFA, 2020.