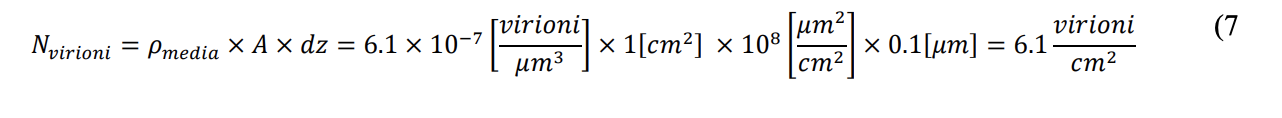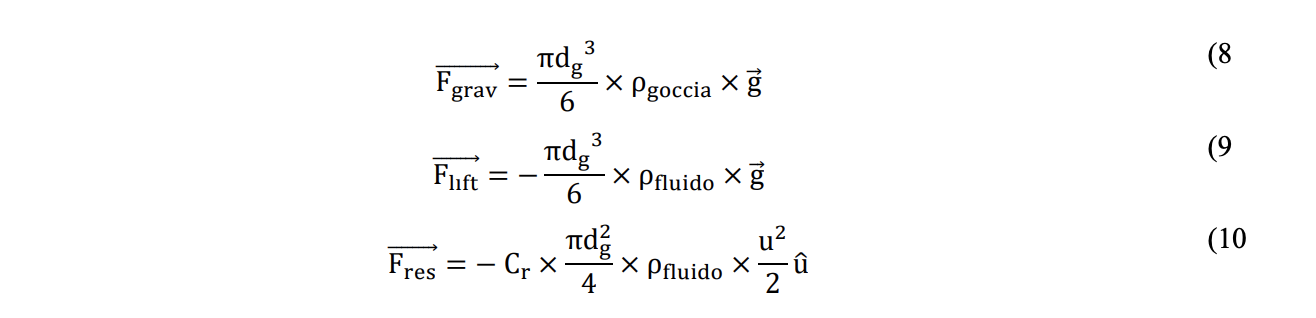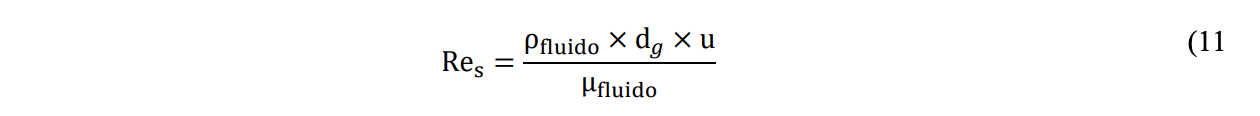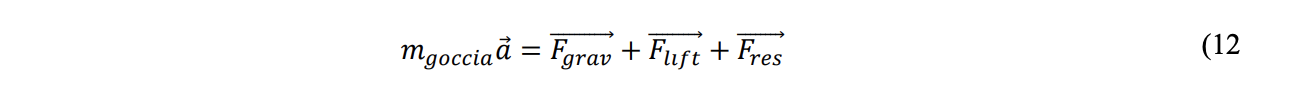Autori: Maria Pia Fantini1, Davide Gori1, Alessandro Guzzini2, Marco Pellegrini2, Maria Carla Re3, Chiara Reno1, Greta Roncarati3, Cesare Saccani2,* , Caterina Vocale3
1 Dipartimento di Scienze Biomediche e Neuromotorie, Università di Bologna, Italia.
2 Dipartimento di Ingegneria Industriale, Università di Bologna, Italia
3 CRREM, UOC Microbiologia, IRCSS Policlinico S. Orsola, Università di Bologna, Bologna, Italia
_____________________________
Abstract
In questo articolo vengono analizzati i principali meccanismi di diffusione del virus SARS-CoV-2, fornendo elementi utili per la corretta gestione per il contrasto alla diffusione del virus stesso.
Lo studio prende le mosse dalla constatazione che, allo stato dell’arte, manca una terminologia rigorosa e univocamente accettata nella letteratura tecnico-scientifica con riferimento alle modalità con cui può avvenire la trasmissione del contagio di SARS-CoV-2 e, in particolare, alle modalità di trasporto cosiddette “droplet” e “airborne”.
La corretta analisi dei meccanismi che governano la diffusione del virus non può prescindere da una rigorosa definizione dei termini che entrano in gioco nella descrizione dei fenomeni, da cui discendono importanti indicazioni volte a determinare soluzioni tecniche finalizzate alla minimizzazione del rischio di contagio.
Partendo dalla definizione di una terminologia rigorosa ed univoca, attraverso l’applicazione un nuovo modello per lo studio della propagazione del contagio, lo studio, sulla base di valutazioni fisico-matematiche, dà ragione di come il contagio avvenga solo mediante goccioline, sole a poter veicolare efficacemente il virus.
Sulla base di queste valutazioni, lo studio analizza il trasporto del virus, incluso nelle goccioline, sulla base dei principi della termo-fluidodinamica, ovvero accoppiando alle equazioni del moto le equazioni che descrivono la variazione di massa per evaporazione. Infatti, la gittata di una goccia emessa da un soggetto infetto, ovvero la distanza di sicurezza da mantenere per minimizzare il rischio di contagio, dipende da numerosi parametri fra i quali, di notevole importanza, il grado igrometrico dell’ambiente in cui questa, la goccia, si trova: da esso, infatti, dipende la velocità di evaporazione e, quindi, la sussistenza della goccia.
Pertanto, lo studio dimostra che il controllo del trasporto del contagio non può essere affrontato in assenza di controllo del grado igrometrico dell’ambiente in cui la goccia si muove: infatti, la definizione stessa di distanza di sicurezza perderebbe di significato in quanto la gocciolina potrebbe “sopravvivere” nell’ambiente con elevata umidità, anche per tempi lunghi e realizzando percorsi casuali, qualora le goccioline fossero al di sotto di certe dimensioni.
A conclusione dello studio, è riportato un caso di studio che dimostra non solo la correlazione fra grado igrometrico e distanza di sicurezza ma anche che la trasmissione del contagio di tipo airborne, ovvero tramite virioni rilasciati a seguito di evaporazione della goccia, in virtù della loro bassissima concentrazione e del moto di tipo browniano che li caratterizza, abbia una probabilità del tutto trascurabile rispetto alla trasmissione dell’infezione da SARS-CoV-2.
1. Definizione delle modalità di trasporto aereo dei virus
Con riferimento ai meccanismi con cui può avvenire la trasmissione aerea del virus SARS-CoV-2, occorre premettere che nella letteratura scientifica di tipo medico manca una terminologia univoca e condivisa con altri settori scientifico-disciplinari, in particolare per quanto riguarda le modalità di trasporto dei virus con importante riflessi sulle definizioni delle modalità di diffusione. Si analizzino, per esempio, le seguenti due definizioni:
- Modalità di trasporto cosiddetta airborne: definita come quella modalità di trasporto in cui la particella solida che ospita il virione risulti aerotrasportata, ovvero, il cui movimento sia conseguente al moto della corrente fluida che la trasporta.
- Trasmissione del contagio attraverso aerosol, in accordo alla definizione fornita dall’Organizzazione Mondiale della Sanità (OMS): “Aerosol transmission refers to the possibility that fine aerosol particles,…., which are generally considered to be particles <5μm in diameter, remain airborne for prolonged periods and be transmitted to others over distances greater than 1 m” (OMS, 2020).
Dalle due definizioni non è chiaro se ci si riferisca a particelle così fini da rimanere in sospensione in aria calma come conseguenza di moti Browniani, ovvero senza componente di moto del fluido di trasporto, oppure se le definizioni includano anche particelle di dimensioni più grandi ed in movimento in sospensione fluida come conseguenza della velocità di trascinamento della corrente che le trasporta.
Chi scrive ritiene che la terminologia migliore, in quanto rigorosa, univoca e più adatta allo studio dei modelli che si riferiscono alla propagazione ambientale delle particelle, sia la seguente:
- Airborne: si definisce come tale il trasporto di particelle solide in sospensione fluida nell’ambiente considerato, comunque esse siano trasportate, ossia indipendentemente dalla velocità di trasporto della corrente fluida che le contiene, comprendendo quindi anche il trasporto di particelle ultrafini soggette a moti browniani;
- Droplet: si definisce come tale il trasporto di goccioline nell’ambiente esaminato, indipendentemente dalla dimensione e comunque esse siano
Si fa presente che molta della letteratura scientifica attuale, in particolare per la trasmissione del virus SARS-CoV-2, fa riferimento alla modalità cosiddetta “airborne” anche per indicare emissione da parte dei soggetti infetti di goccioline di secrezioni ultrafini (dimensioni <5 micron) (come ad esempio nella lettera firmata da 239 ricercatori indirizzata alla WHO) (Morawska et al. 2020) [239 ricercatori]. Ciò provocherebbe confusione quando ci si addentrasse nell’analisi termo fluidodinamica che segue in quanto la gocciolina rappresenta una massa potenzialmente variabile, in funzione delle caratteristiche ambientali, mentre non è così per la particella solida.
La classificazione che individua la trasmissione droplet indipendentemente dalla dimensione delle goccioline, esclude in maniera chiara e univoca il particolato solido come vettore di potenziale contagio (Bontempi, 2020; Domingo et al., 2020). Inoltre, la distinzione tra vettore solido e gocciolina consente di limitare lo studio dell’impatto delle condizioni termo-igrometriche, cioè temperatura e grado di umidità, dell’aria ambiente riferite al solo caso droplet. Infatti, la gittata di una gocciolina emessa da un soggetto infetto dipende, oltre che dalla sua dimensione e dalla velocità iniziale, anche dalla velocità di trascinamento della eventuale corrente di trasporto, e dalla propria capacità di evaporare in funzione delle condizioni termo-igrometriche dell’ambiente in cui si trova.
Nel caso invece di trasporto del virus in modalità che consideriamo propriamente “airborne” (attraverso particolato solido) le condizioni termo-igrometriche potrebbero avere influenza sul moto della particella solida solo nel caso in cui essa agisca come nucleo di condensazione in un ambiente sovra-saturo. Quest’ultima condizione può rivestire grande interesse per inferire meccanismi di trasporto del virus e di infezione, ad esempio all’interno delle vie aeree. Si consideri, per esempio, il caso di una particella solida inalata all’interno dei polmoni dove è ragionevole ipotizzare la presenza di un ambiente saturo. In caso di temperatura superficiale della particella solida sufficientemente bassa, questa, potrebbe diventare un nucleo di condensazione, ovvero una particella bagnata. Questa modifica sostanziale delle condizioni di trasporto del virus consentirebbe il ritorno al trasporto in modalità droplet con nucleo solido all’interno dell’albero respiratorio e con la conseguenza che la gocciolina potrebbe impattare la superficie degli alveoli e ivi depositarsi per formare un nucleo di infezione.
2. Relazione tra carica virale, dimensione della gocciolina e grado igrometrico dell’aria ambiente
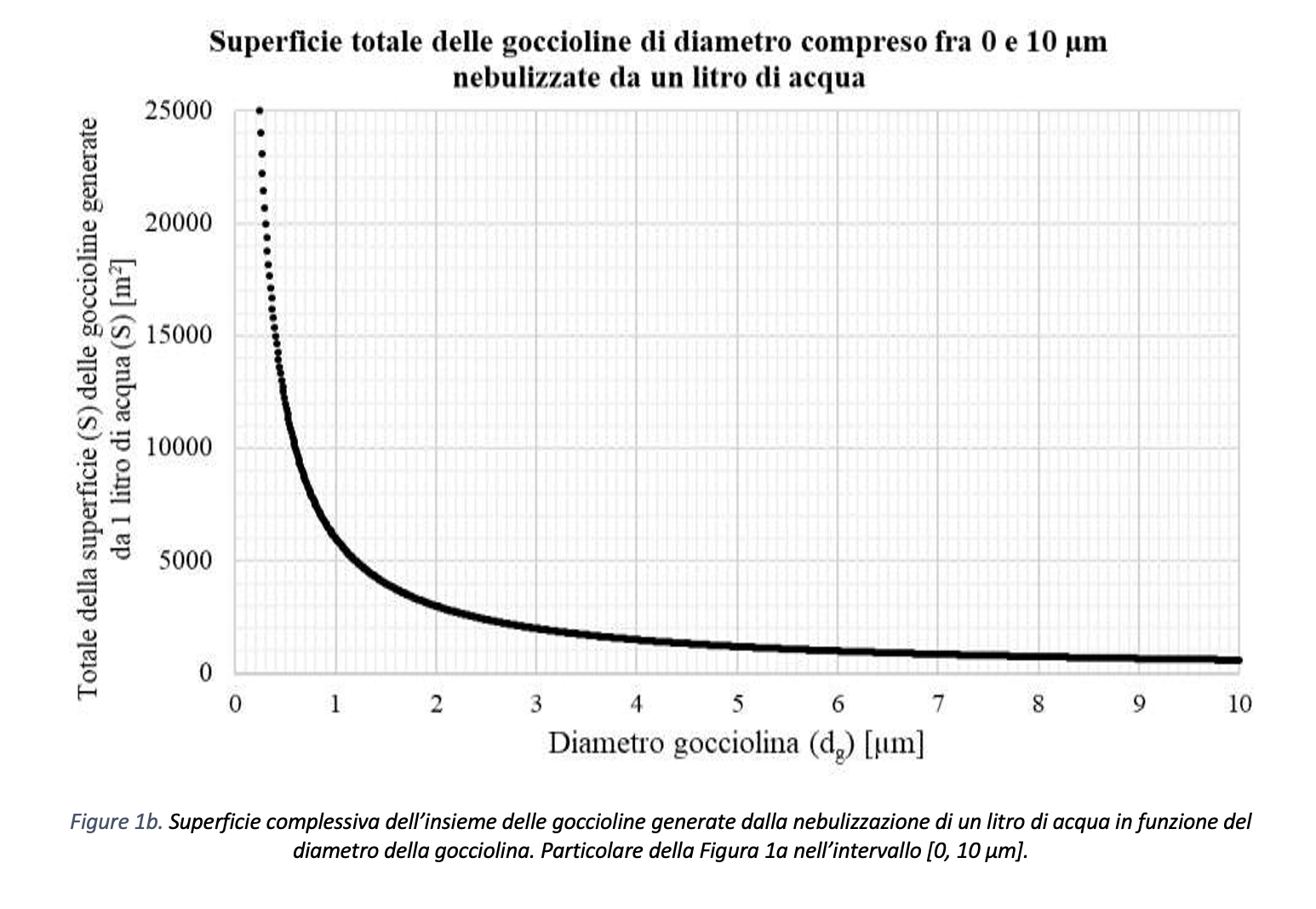
Nello studio del moto delle goccioline, ovvero della distanza di sicurezza da mantenere per evitare la diffusione del contagio, si devono considerare anche i fenomeni di natura termo-igrometrica in relazione alle dimensioni della gocciolina stessa. Come mostrato in Figura 1a, l’andamento della superficie totale a disposizione per scambiare calore e massa con l’aria ambiente delle goccioline nebulizzate da un litro di acqua è proporzionale all’inverso del diametro dell’insieme delle goccioline stesse. In Figura 1b è riportato l’andamento della superficie totale per goccioline di diametro compreso fra 0 e 10 µm nebulizzate da un litro di acqua. L’andamento fa sì che i fenomeni di scambio termico e trasferimento di massa per evaporazione aumentino al diminuire del diametro della gocciolina.
Il fenomeno di evaporazione della gocciolina emessa da un soggetto infetto influisce non solo sulla sua gittata, ma anche sulla concentrazione virale della stessa. Per concentrazione virale si intende il numero di virioni per unità di volume. Partendo da considerazioni di tipo geometrico e fisico, si può affermare come una goccia possa contenere un numero di virioni massimo secondo una relazione che dipende dalla dimensione del virione e dalla dimensione (diametro) della goccia stessa. Pertanto, ad ogni gocciolina in grado di trasportare il virus può essere associato un valore massimo in numero di virioni, ovvero una concentrazione massima che andrà poi confrontata con la carica virale minima infettante. Dai dati di letteratura si evince che la dimensione del virione (SARS-CoV-2, considerato sferico, possa variare fra 0.06 e 0.15 μm (Zhu et al., 2020). Pertanto, una gocciolina di diametro inferiore a quella del virione non è in grado di includerlo e di trasportarlo nell’ambiente.
D’altro canto, le goccioline di dimensione maggiore di quelle del virione, e quindi in grado di ospitarne almeno uno, se emesse dal soggetto infetto in un ambiente relativamente secco vedono ridurre progressivamente il proprio volume per evaporazione. Le goccioline, qualora molto piccole, possono quindi evaporare completamente durante il loro percorso, rilasciando in ambiente la propria carica virale prima di raggiungere il bersaglio finale, ovvero molto prima di poter propagare il contagio. Segue che il diametro della gocciolina in grado di trasportare una carica virale significativa fino al soggetto ricevente (bersaglio) va identificata valutando con attenzione il meccanismo sopra descritto di progressiva riduzione del volume della gocciolina per evaporazione.
Si prenda allora in esame il caso di una goccia che raggiunga il bersaglio (soggetto suscettibile) con un diametro pari a 10 μm. Sulla base di semplificazioni di tipo geometrico, ovvero i) ipotizzando goccia e virione di forma sferica, ii) assumendo un grado di riempimento della gocciolina pari al 61% (Benenati & Brosilow, 1962), e
iii) associando al virione una dimensione sferica media pari a 0.1 μm, avremo che il volume di una goccia di diametro pari a 10 μm potrà ospitare al massimo 610.000 virioni, con una concentrazione virale massima di 1165 virioni/μm3. Esiste, dunque, una carica virale massima che ogni gocciolina può trasportare e che è identificabile in maniera univoca note le dimensioni del virione. Nella tabella 1 sono riportati i calcoli in accordo alle ipotesi effettuate.

Se la dimensione della goccia all’emissione fosse di 100 μm a parità di numero di virioni contenuto, ovvero
610.000 virioni, rispetto alla gocciolina da 10 μm vista in precedenza, questa avrebbe avuto in partenza una concentrazione virale pari a 1,165 virioni/μm3, ovvero un millesimo della precedente. Pertanto, durante il processo di riduzione volumetrica per evaporazione, ipotizzando di non perdere virioni dalla goccia di partenza (ipotesi prudenziale), si può affermare che una particella di 100 μm, con concentrazione virale pari a 1,165 virioni/μm3, qualora scendesse fino alle dimensioni di 10 μm di diametro, raggiungerebbe una concentrazione di 1165 virioni/µm3, ovvero mille volte superiore a quella iniziale, e pari a quella massima.
Si può allora affermare che alla riduzione del volume della goccia consegue, in modo inversamente proporzionale, un aumento della concentrazione virale rispetto a quella iniziale rilevata nell’istante di emissione da parte del soggetto infetto, sino al raggiungimento di un valore massimo che è geometricamente identificabile. Pertanto, il soggetto suscettibile (target), in caso di evaporazione incompleta delle gocce, risulterebbe raggiunto da goccioline caratterizzate da dimensione inferiore a quelle iniziali (all’emissione), ma con una concentrazione virale maggiore.
3. Valutazioni quantitative sul processo di evaporazione della gocciolina infetta
Poiché le goccioline di diametro pari o inferiori a 10 μm hanno maggior probabilità di raggiungere le basse vie respiratorie (Gralton et al., 2020), la letteratura medica concorda sul fatto che questa tipologia di goccioline sia la più pericolosa. Tuttavia, il diametro soglia di 10 μm fa riferimento al punto di inalazione da parte del soggetto suscettibile, e non al punto di emissione da parte del soggetto infetto. Dunque, rimane da chiarire quale sia la dimensione critica iniziale della goccia all’emissione.
Si faccia allora riferimento alla Figura 2. Il soggetto infetto emette goccioline, identificate da una propria distribuzione dimensionale e, verosimilmente, aventi la stessa concentrazione virale iniziale. Infatti, è ragionevole pensare che tutte le goccioline, avendo origine nello stesso punto ed essendo prodotte dallo stesso fluido, indipendentemente dalla propria dimensione, abbiano la stessa concentrazione virale all’atto dell’emissione. Lungo la loro traiettoria, le goccioline riducono il proprio volume per effetto della evaporazione, incrementando così la concentrazione virale presente al loro interno. Per fare un esempio: una gocciolina di diametro iniziale pari a 100 μm, riducendo il proprio volume lungo la traiettoria, raggiungerebbe il soggetto bersaglio o si depositerebbe su una superficie inanimata ad una concentrazione virale nettamente superiore a quella di partenza. Viceversa, goccioline di diametro iniziale, pari o inferiori a 10 μm tenderanno ad evaporare completamente prima di raggiungere il soggetto bersaglio. Sulla base di queste considerazioni, si può affermare che la gocciolina da 10 μm, che se inalata ha buone probabilità di raggiungere le superfici respiratorie e veicolare il contagio, fosse in partenza caratterizzata da una dimensione maggiore e da una concentrazione virale inferiore.
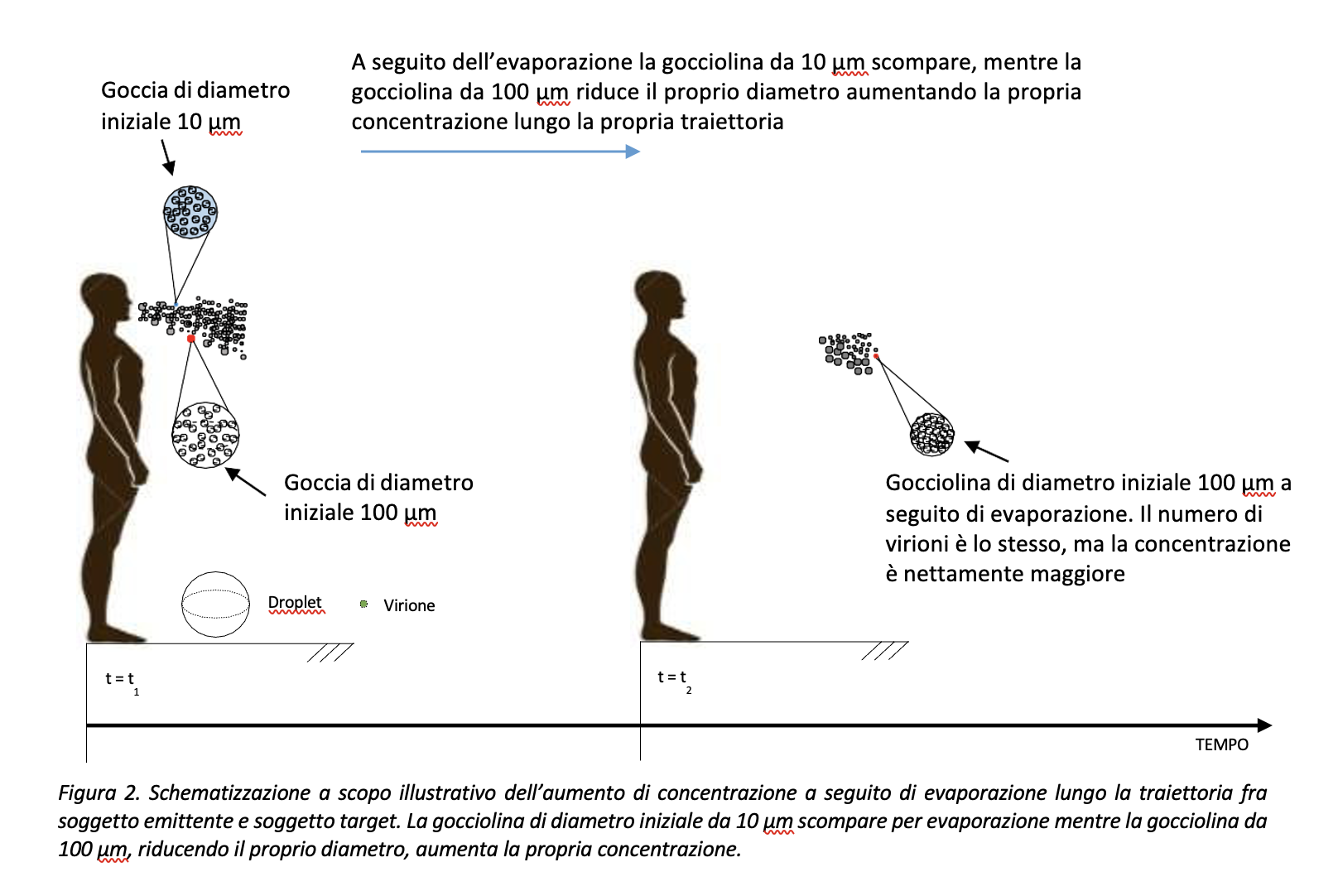
Al fine di descrivere il rischio di diffusione del contagio, le dimensioni delle goccioline dovrebbero essere sempre riferite al punto di emissione, ovvero alla partenza dal soggetto potenzialmente infetto, e non al bersaglio, ovvero all’arrivo in prossimità del potenziale target o della superficie su cui la goccia, o ciò che ne rimane a seguito di evaporazione, si deposita. Infatti, in assenza di distinzione fra le dimensioni all’origine e al raggiungimento del bersaglio l’analisi del fenomeno di diffusione trascurerebbe implicitamente l’intensità del fenomeno, ovvero il potenziale impatto negativo della concentrazione virale.
Al fine di chiarire il concetto sopra esposto, è opportuno introdurre la metodologia per il calcolo della gittata per una gocciolina che sta evaporando. In premessa occorre sottolineare che il volume della gocciolina emessa dal soggetto infetto, tenendo conto delle considerazioni fatte sul grado di riempimento, è occupato da acqua solo in parte, mentre la restante parte è occupata dai virioni. Assumendo un grado di riempimento della gocciolina del 61%, solo il 39% del volume della gocciolina risulta costituito da acqua (secrezione liquida). Sulla base delle informazioni note nella letteratura tecnico-scientifica non si può escludere con ragionevole certezza che il tempo che la goccia impiega per evaporare completamente sia pari, nell’esempio riportato, al 39% di quello che la goccia avrebbe impiegato nel caso fosse stata costituita solo da acqua, ovvero in assenza di virioni. D’altro canto, non è noto, per esempio, se i virioni ostacolino il trasferimento di materia per evaporazione trattenendo acqua nella gocciolina. Ugualmente, non è nota la capacità termica del virione, ovvero quanto tempo impiega per raggiungere l’equilibrio termico con l’acqua che lo circonda. Pertanto, il fenomeno di evaporazione sarà studiato assumendo, rispetto ai punti su cui vi è incertezza, la seguente ipotesi: la riduzione, a parità di diametro, del tempo di evaporazione della gocciolina conseguente al minor volume di acqua contenuto per la presenza dei virioni, viene compensata dall’ostacolo che i virioni stessi potrebbero porre in essere con la loro presenza all’evaporazione dell’acqua.
Sono numerosi, ed hanno radici lontane nel tempo, gli studi volti a modellare il processo di evaporazione di una gocciolina sulla base dei principi della termo-fluidodinamica (Wells, 1934; Kukkonen et al., 1989; Ferron & Soderholm, 1990, Xie et al., 2007). Con riferimento ad una gocciolina da 10 μm, si è di seguito implementato il modello proposto da (Xie et al., 2007) su piattaforma Matlab. Per i calcoli sono stati assunti i seguenti valori:
- temperatura ambiente pari a 20 °C,
- velocità di lancio pari a 9 m/s, ovvero la velocità media delle particelle all’istante di emissione durante l’attività fonatoria (Chao et al., 2009),
- assenza di correnti di trasporto, ovvero velocità di trascinamento ambientale
Si consideri il modello di una goccia che evapora con le ipotesi introdotte. Si riportano in Figura 3 i risultati della simulazione effettuata assumendo un grado igrometrico dell’ambiente variabile fra 0% e 95%. La Figura 3 rappresenta il grafico normalizzato del tempo di evaporazione di gocce aventi diametro iniziale rispettivamente pari a 10 µm e 100 µm al variare del grado igrometrico. I risultati sono riferiti a due scale differenti, riportate in ordinata: a sinistra quella relativa alla goccia da 100 micron, a destra quella riferita alla goccia da 10 micron. I tempi di evaporazione sono stati normalizzati rispetto al tempo di evaporazione di una goccia di diametro iniziale pari a 100 µm in un ambiente a grado igrometrico del 90%, ovvero un tempo calcolato pari a 77.2 secondi. I calcoli risultano in accordo con le stime effettuate anche da Xie et al., 2007, riportati in Figura 4 e 5. Il tempo richiesto per l’evaporazione della gocciolina, rappresentato in ordinata, aumenta considerevolmente con il grado di umidità dell’ambiente in cui si trova (riportato in ascissa). Pertanto, poiché il tempo di persistenza della gocciolina aumenta con il grado di umidità, è ragionevole ipotizzare che anche il rischio di diffusione dell’infezione virale aumenti con il grado di umidità dell’ambiente in cui si trovano il soggetto infetto (emittente) ed il soggetto suscettibile (target). È importante osservare che, pur con scale molto diverse (quasi due ordini di grandezza), l’andamento dei tempi di evaporazione in funzione del grado igrometrico è simile per le due goccioline.
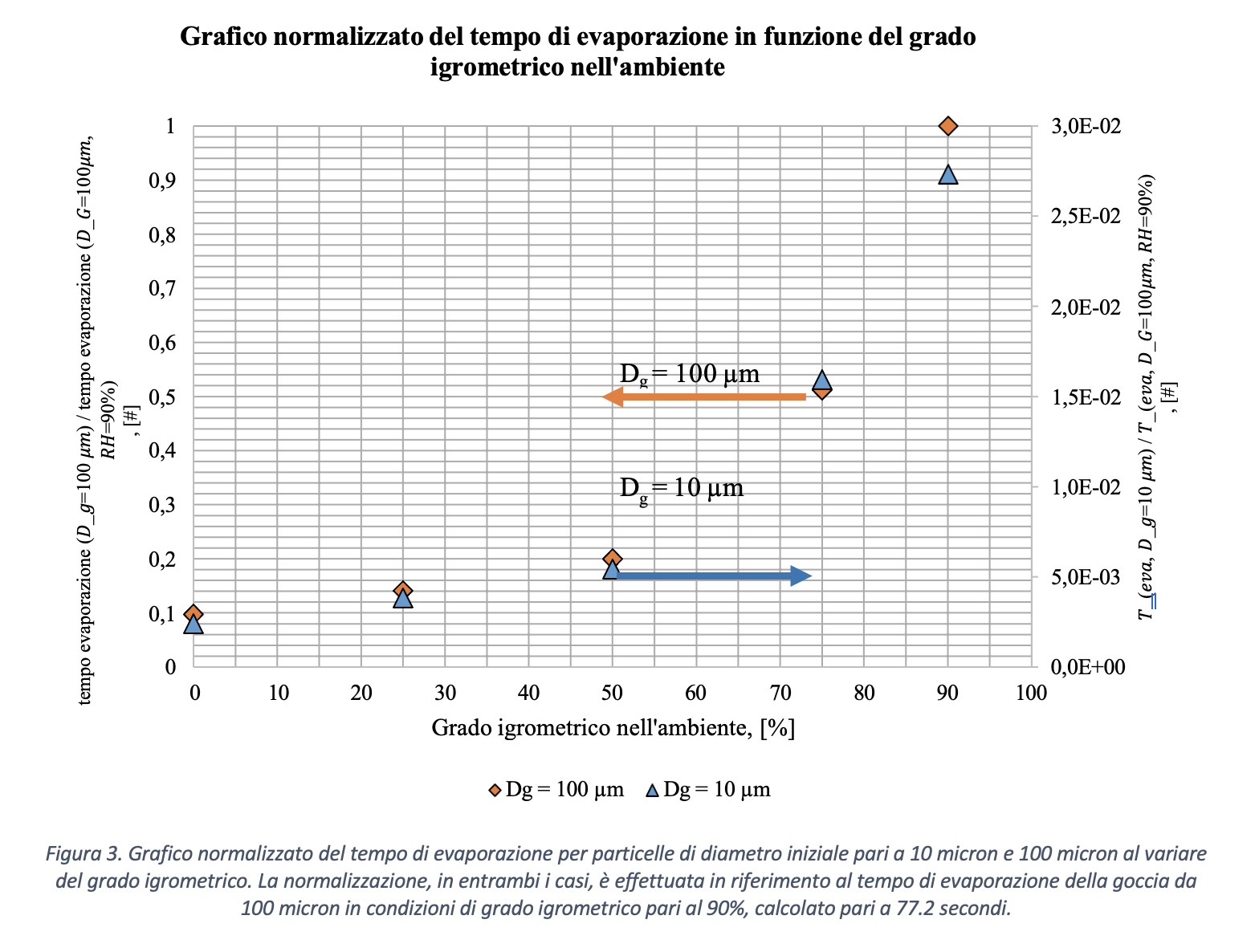
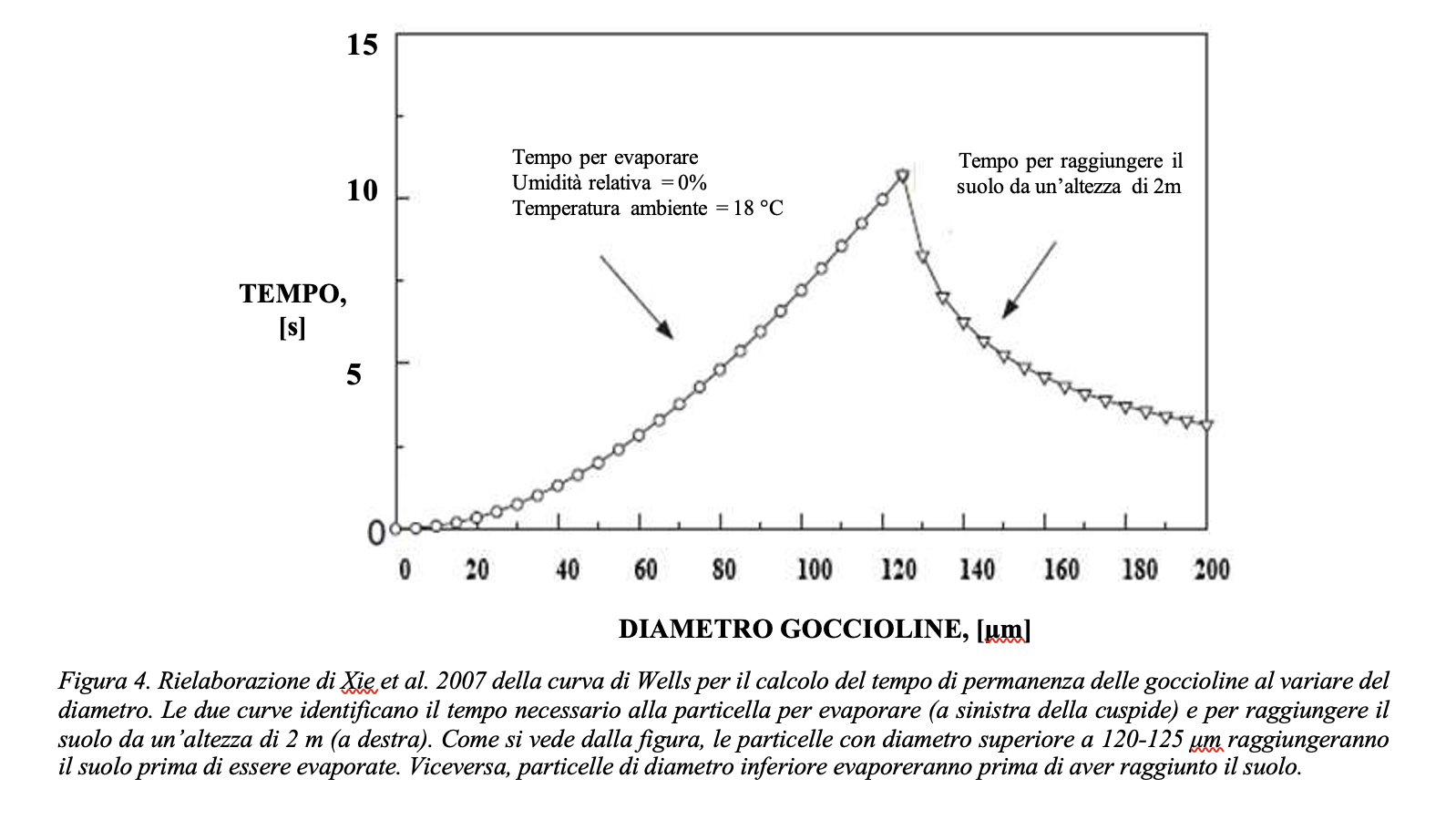
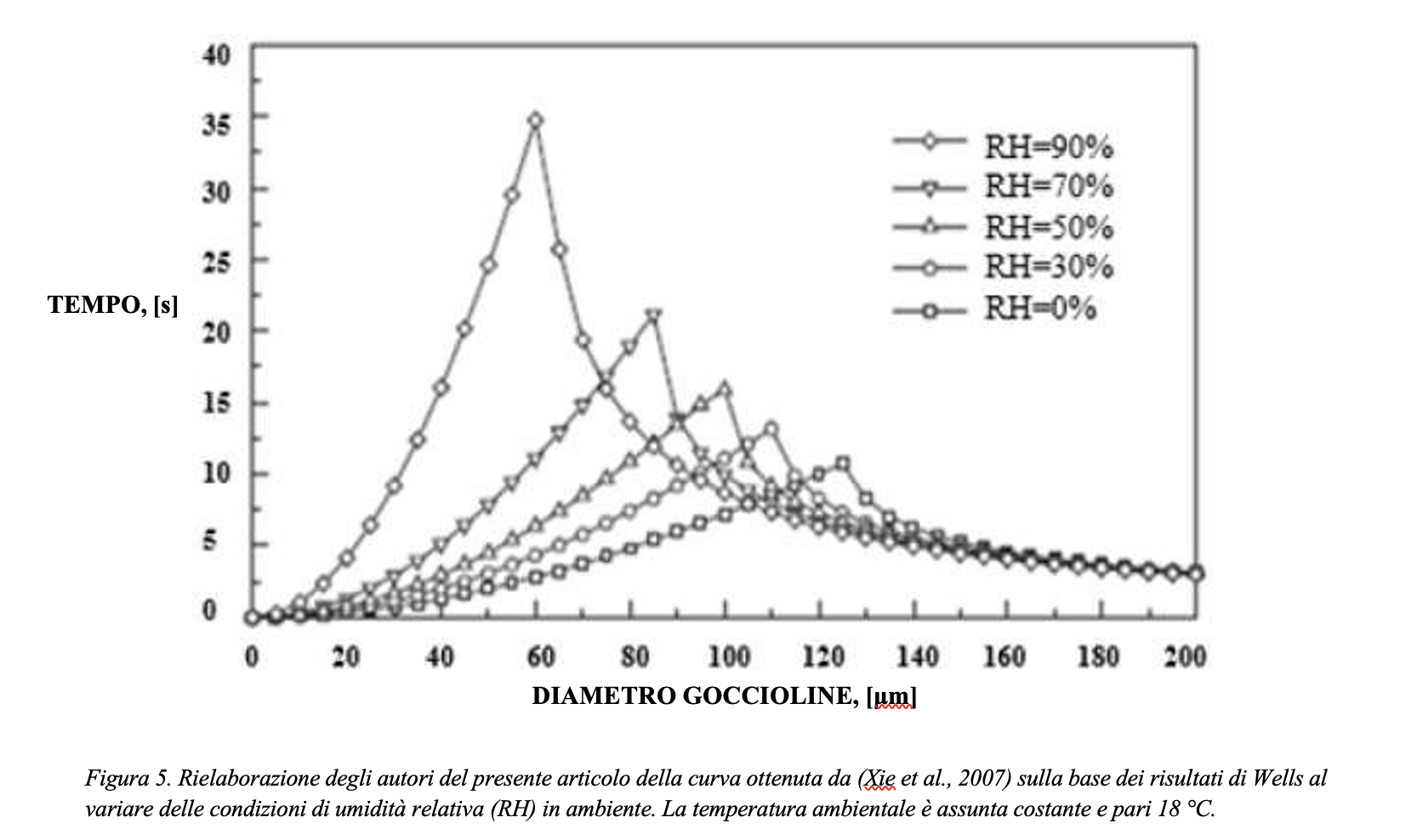
Se definiamo la distanza di sicurezza come la distanza oltre la quale si può assumere che la gocciolina emessa dal soggetto infetto sia precipitata in un luogo dove non rappresenti una minaccia, ovvero sia evaporata (e dunque la concentrazione dei virioni sia praticamente nulla ed incapace di infettare), da quanto sopra esposto appare chiaro come la distanza di sicurezza sia significativamente influenzata dal grado igrometrico dell’ambiente in cui la gocciolina si venga a trovare. A conferma di ciò, la Figura 5 evidenzia una notevole impennata del tempo di permanenza per valori del grado igrometrico (RH) superiori al 60-70%.
In Figura 6 è riportato l’andamento nel tempo del volume, in mL, di goccioline aventi diametro iniziale pari a 10 μm, 25 μm, 50 μm, 75 μm e 100 μm in un ambiente caratterizzato da grado igrometrico RH costante, pari al 50%, e temperatura ambiente pari a 20 °C. Il grafico è stato realizzato dagli autori rielaborando dati di letteratura. La gocciolina di diametro pari a 10 μm evapora completamente in una frazione di secondo. La gocciolina da 100 μm dopo 7 sec dall’atto dell’emissione, ovvero a circa metà del processo di completa evaporazione, possiede un volume residuo pari a circa 1.4 x 10-7 mL, ovvero un diametro pari a circa 64 μm. Per quanto sopra esposto, questa riduzione di volume (e diametro) produce una concentrazione virale 3.7 volte superiore a quella iniziale. La gocciolina da 75 μm, nello stesso istante (dopo 7 secondi dalla emissione), possiede un volume residuo pari a circa 2 x 10-8 mL, ovvero presenta un diametro pari a 34 μm, quindi una concentrazione 10 volte superiore a quella iniziale. Come mostra la Figura 5, la gocciolina da 100 μm, dopo circa 15 secondi, risulta quasi completamente evaporata.
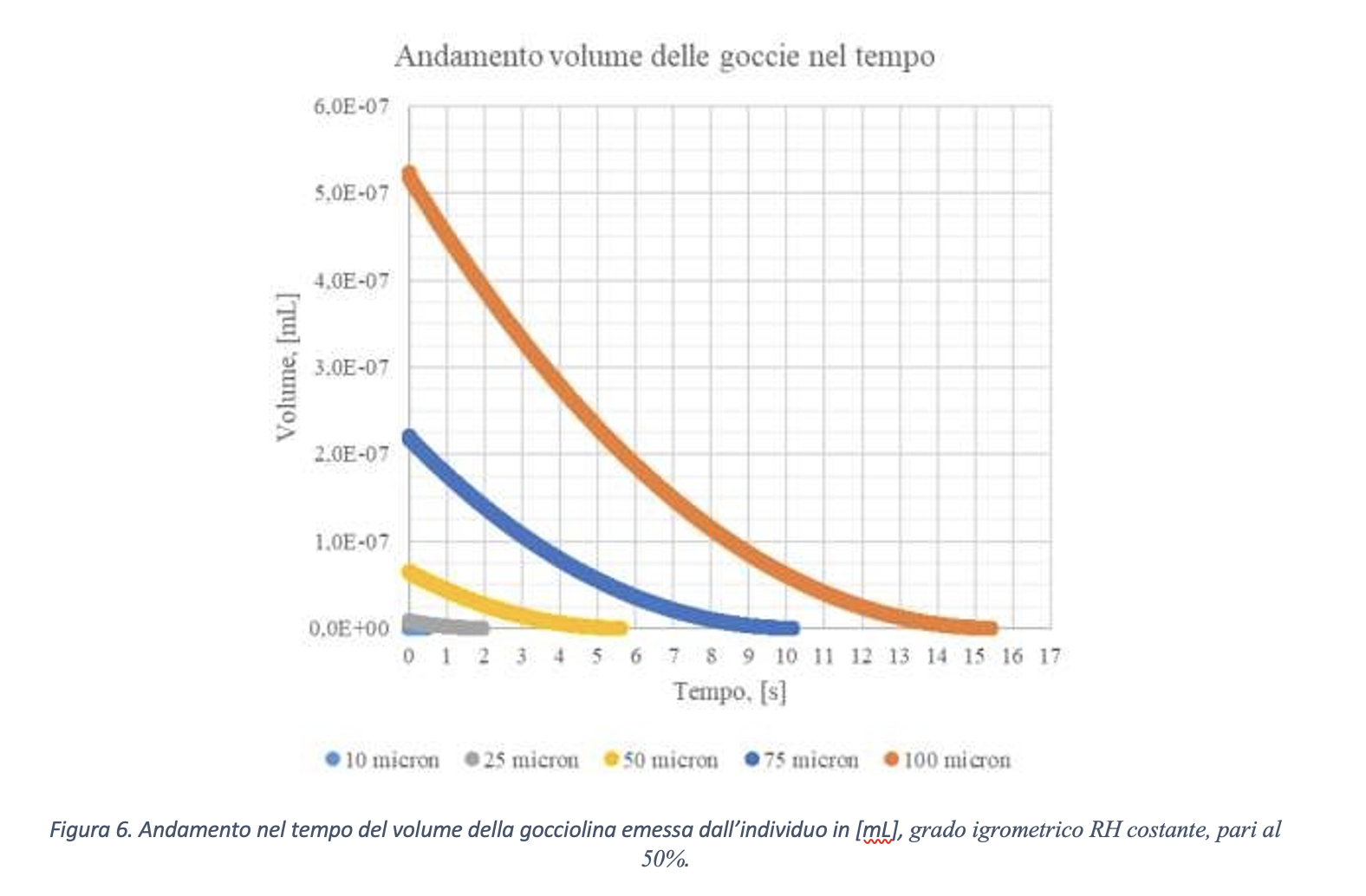
È ragionevole pensare che la completa evaporazione della gocciolina possa ridurre il rischio di veicolazione della diffusione di contagio da virus SARS-CoV-2. Infatti, la goccia, raggiunta la propria concentrazione massima in conseguenza alla riduzione per evaporazione del proprio volume, inizia a rilasciare i virioni nell’aria circostante perché non è più in grado di contenerli al proprio interno. Si prenda come riferimento il numero di virioni massimo contenuto in una goccia da 10 μm, ovvero, per quanto visto in precedenza, 610.000 unità. Al ridursi del volume, i virioni che non possono più essere contenuti sono rilasciati in un volume molto piccolo e che circonda la gocciolina evaporata. Supponiamo che questo volume sia pari, ad esempio, ad 1 cm3. Assumendo la completa evaporazione della gocciolina, ovvero il rilascio di tutti i 610.000 virioni, si otterrebbe, nel cm3 di rilascio, una concentrazione virale di 6.1 x 10-7 virioni/μm3. In precedenza, nella gocciolina, si aveva una concentrazione di 1165 virioni/μm3.
Sulla base della letteratura esistente sembrerebbe emergere che la concentrazione virale giochi in vitro un ruolo negativo in riferimento alla velocità di diffusione del virione nelle cellule di colture cellulari (Yin & McCaskill, 1992). Difatti, se è vero che la diffusione dell’infezione nelle colture cellulari è correlata al numero di virioni per cellula, ovvero al parametro MOI (Multiplicity of Infection), è altresì vero che la rapidità con cui i virioni si diffondono dipende dalla concentrazione con cui il virus viene addizionato alla coltura. In altre parole, operando su due colture cellulari aventi lo stesso MOI, ovvero a parità del numero di virioni e di cellule presenti in coltura, se i virioni vengono introdotti con una concentrazione più elevata nella coltura A rispetto alla coltura B, i virioni presenti nella coltura A aggrediranno lo stesso numero di cellule della coltura B, ma in un tempo inferiore. Di conseguenza, alla dispersione in aria dei virioni, ovvero alla riduzione della concentrazione virale, dovrebbe seguire una minore probabilità di infezione. Questo fenomeno trova spiegazione nel fatto che una maggiore concentrazione virale porta a ridurre la distanza media fra cellula e virione. Come conseguenza di ciò, i contatti tra virione e potenziali cellule degli organi in cui il virus penetra, a parità di velocità del moto del virione che incontra la cellula, avvengono in tempi più brevi e, verosimilmente, inversamente proporzionali alla concentrazione stessa. Con riferimento all’esempio sopra illustrato, il rapporto fra le due concentrazioni (quella nella goccia e quella nel cm3 di rilascio) è pari a 1165/(6.1 x 10-7) = 1.909.836.066. In altre parole, la concentrazione virale nel cm3 circostante la goccia evaporata è quasi due miliardi di volte inferiore rispetto alla concentrazione massima nella goccia. Quindi, la concentrazione virale risulta assai elevata e, potenzialmente, con grande capacità infettiva fintantoché i virioni siano contenuti all’interno della gocciolina. In definitiva, la goccia (droplet) funge non solo da veicolo di trasporto del virione, ma anche e da elemento di concentrazione della carica virale.
4. Considerazioni sulla trasmissione airborne
I virioni rilasciati dalla goccia a seguito della completa evaporazione sono verosimilmente bagnati e, quindi, facilmente confondibili con la goccia. Però, mentre la goccia, se non contiene alcun virione, non può contaminare, il virione, ancorché bagnato sulla superficie e non identificabile come aerosol, può contaminare. È, infatti, verosimile pensare che, in ambiente asciutto, il film liquido evapori rapidamente in ragione del fatto che, per tali dimensioni, il rapporto fra superficie evaporante e massa di acqua è altissimo, come mostrato in figura 1a e figura 1b. In particolare, nel caso specifico, poiché la massa di acqua non occupa l’intero volume ma solo il film esterno, a seguito dell’evaporazione di questo, il virione si trova allo stato naturale.
Data la dimensione del singolo virione, ovvero nell’intervallo [0.06 µm, 0.15 µm], volendo approcciare il problema della mobilità dello stesso in aria, si deve fare riferimento a moti di tipo browniano2 (tipici delle particelle aventi le dimensioni minori o uguali a quelle indicate per i virioni), come schematicamente mostrato in Figura 7. Ora, dal momento che i virioni sono dispersi nel volume di aria inalato, quelli che possono andare a contatto con le cellule dell’albero respiratorio o, comunque, con superfici infettabili sono contenuti in un sottile strato il cui volume si può calcolare come prodotto della superficie di contatto e di uno spessore dz simile alla dimensione del virione.
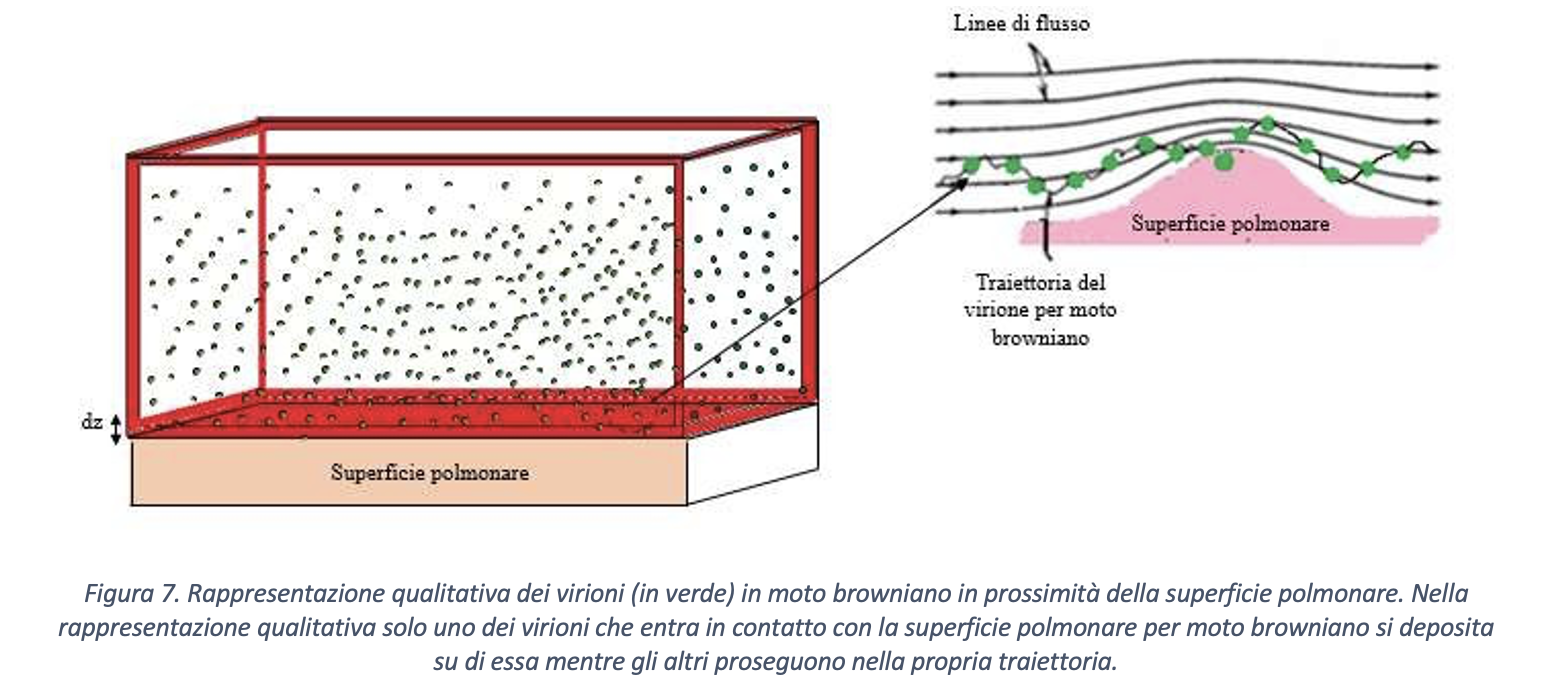
Il numero di virioni (Nvirioni) contenuti all’interno di un volume di controllo di superficie (A) e di altezza dz (in figura) può essere calcolato mediante l’equazione 6:
𝑁𝑣𝑖𝑟𝑖𝑜𝑛𝑖 = 𝜌𝑚𝑒𝑑𝑖𝑎 × 𝐴 × 𝑑𝑧 (6
Dove ρmedia è la concentrazione virale media assunta pari, per considerazioni precedenti, a 6.1 x 10-7 virioni/μm3. Relativamente all’altezza del volume di controllo (dz) si assume un valore pari alla dimensione media dei virioni, ovvero 0.1 µm. Assumendo una superficie (A) pari a 1 cm2, il numero di virioni contenuti è calcolato in accordo all’equazione 7, ovvero pari a:
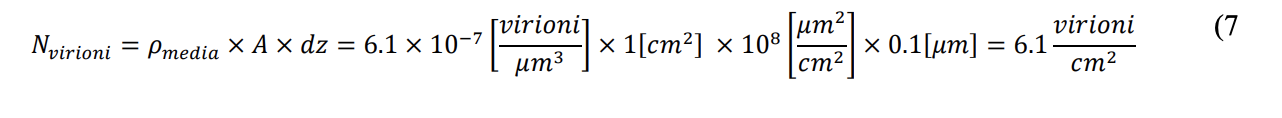
Tale valore può essere definito come il numero massimo di contatti possibili per centimetro quadrato, ovvero il numero di contatti nel caso in cui tutti i virioni nel volume di controllo, come sopra definito, vengano captati dalla superficie del bersaglio anziché permanere in sospensione fluida. Pertanto, la probabilità di contatto fra virioni e la superficie respiratoria è bassissima in quanto è ragionevole pensare che i virioni siano distribuiti uniformemente dentro il volume grazie alla tipologia di moto (browniano) che li contraddistingue. Va sottolineato come i virioni, soggetti a moti browniani, anche avvicinandosi notevolmente alla superfice di contatto non necessariamente vadano a depositarsi su di essa. La probabilità di trasmissione dell’infezione con modalità airborne reale risulta pertanto molto più bassa se confrontata con la modalità droplet, mediante goccioline di dimensioni maggiori che si trasferiscono alla superficie bersaglio con meccanismi di intercettazione o di impatto, determinando così un trasferimento di virioni significativo sia per numero che per concentrazione.
5. Considerazioni sulle modalità di risposta del sistema difensivo umano in caso di trasmissione airborne o droplet
Sulla base di quanto sopra esposto, partendo dalla minore concentrazione virale della modalità di trasmissione airborne rispetto al caso di trasmissione droplet, si può ipotizzare che la probabilità di contagio per trasmissione di tipo airborne possa risultare nulla o trascurabile. Per giustificare questa ipotesi si consideri il concetto di resilienza, ovvero di resistenza alla velocità di cambiamento, e lo si applichi al sistema immunitario umano. L’interazione fra carica virale e superficie polmonare determina una reazione del sistema immunitario che si oppone alla replicazione virale, intesa come formazione di nuove particelle virali nelle cellule infettate dal virus e responsabile di un cambiamento dello stato di salute dell’organismo. Chi scrive ritiene che l’evoluzione del fenomeno, ovvero la capacità del sistema immunitario di contrastare la replicazione virale, dipenda non solo dalla velocità di intervento di questo, ma anche dalla modalità di trasporto del contagio, ovvero airborne o droplet. Si faccia riferimento ai due casi riportati schematicamente in figura 8 e relativi, rispettivamente, al caso di trasporto airborne (CASO 1) e trasporto droplet (CASO 2).
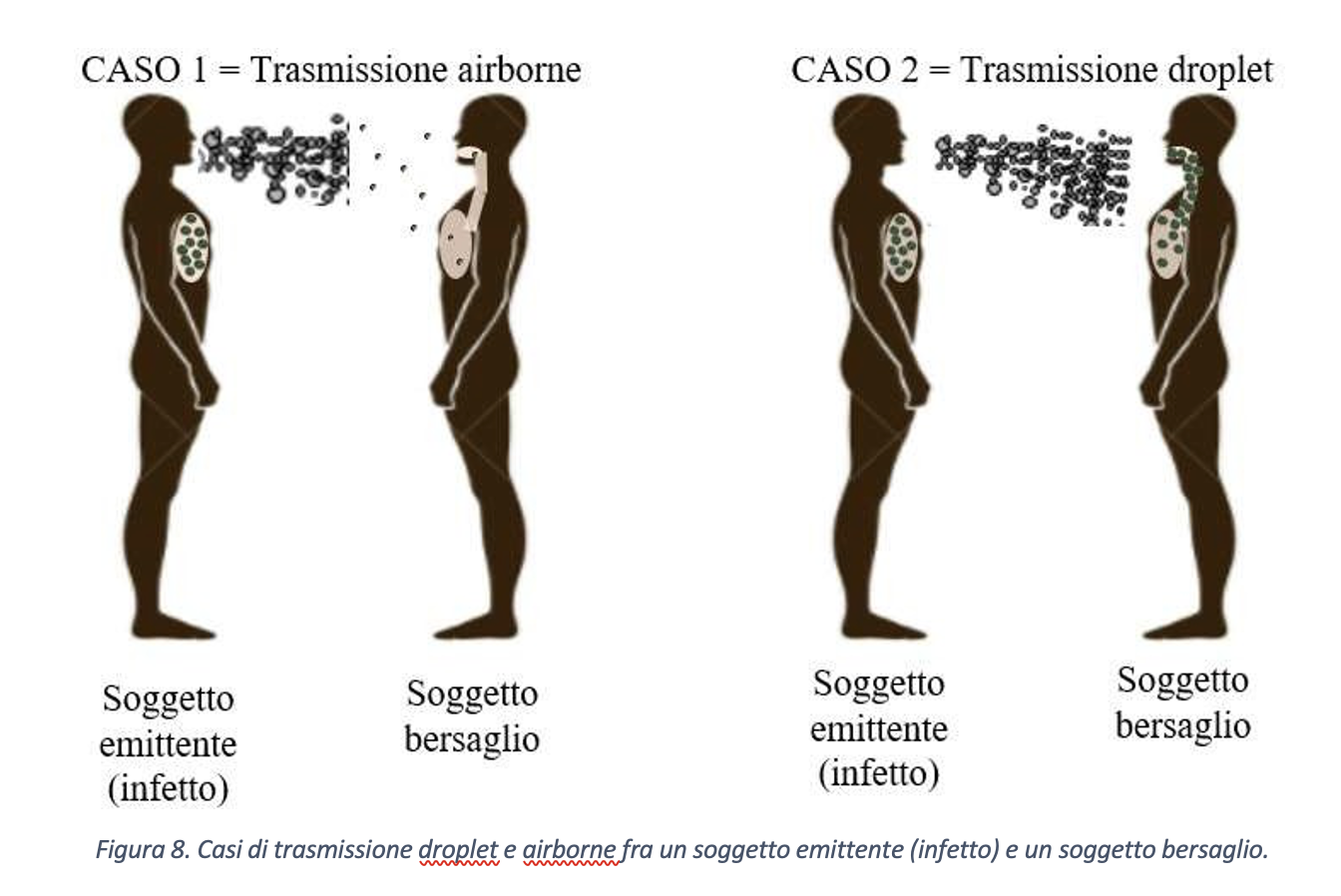
Una schematizzazione di tipo qualitativo della possibile evoluzione nel tempo della carica virale, una volta penetrata nel soggetto suscettibile, per i due casi è riportata in figura 9. Pur essendo ragionevole ipotizzare che, per esempio, la risposta difensiva vada a saturazione dopo un certo periodo di tempo, si suppone, per semplicità, che i fenomeni di aggressione virale e di risposta siano di tipo lineare, quanto meno nelle fasi iniziali del contagio. In entrambi i casi 1 e 2, condizione necessaria per l’arresto della replicazione virale è che la derivata rispetto al tempo della risposta difensiva dell’individuo, ovvero la velocità alla quale il sistema stesso riesce a contrastare il contagio, sia maggiore rispetto alla velocità di replicazione virale. Con riferimento alla figura, condizione geometrica necessaria è che l’angolo αimmunitario sia maggiore degli angoli αcaso 1 e αcaso 2.
Si analizzi il CASO 1. Sulla base delle considerazioni precedenti, la carica virale iniziale nei polmoni è tale da permettere al sistema di difesa di reagire, dopo un certo “tempo morto” che rappresenta il tempo di attivazione del sistema immunitario, con velocità relativamente alta rispetto a quella di propagazione del contagio e, così, di interrompere all’istante t = t1 la replicazione virale e, di conseguenza, la persistenza del virus nel soggetto.
Nel CASO 2, invece, il sistema di difesa paga lo scotto di una elevata carica virale iniziale e, dunque, potrebbe intercettare la curva di crescita della carica virale nel soggetto infettato dopo un tempo t molto maggiore rispetto al caso airborne (CASO 1), ovvero non intercettarla mai. Quest’ultima condizione corrisponde al decesso dell’individuo.
Pertanto, l’analisi proposta permette di effettuare una valutazione di tipo previsionale rispetto alle fasi iniziali dello sviluppo del contagio, una volta nota la carica virale di partenza del soggetto infetto e la modalità di trasferimento del virus al bersaglio (droplet o airborne). In particolare, se l’intersezione tra risposta del sistema immunitario e diffusione del virus avviene all’insorgenza dell’attacco virale, probabilmente, il soggetto bersaglio mostrerà una risposta di tipo asintomatica.
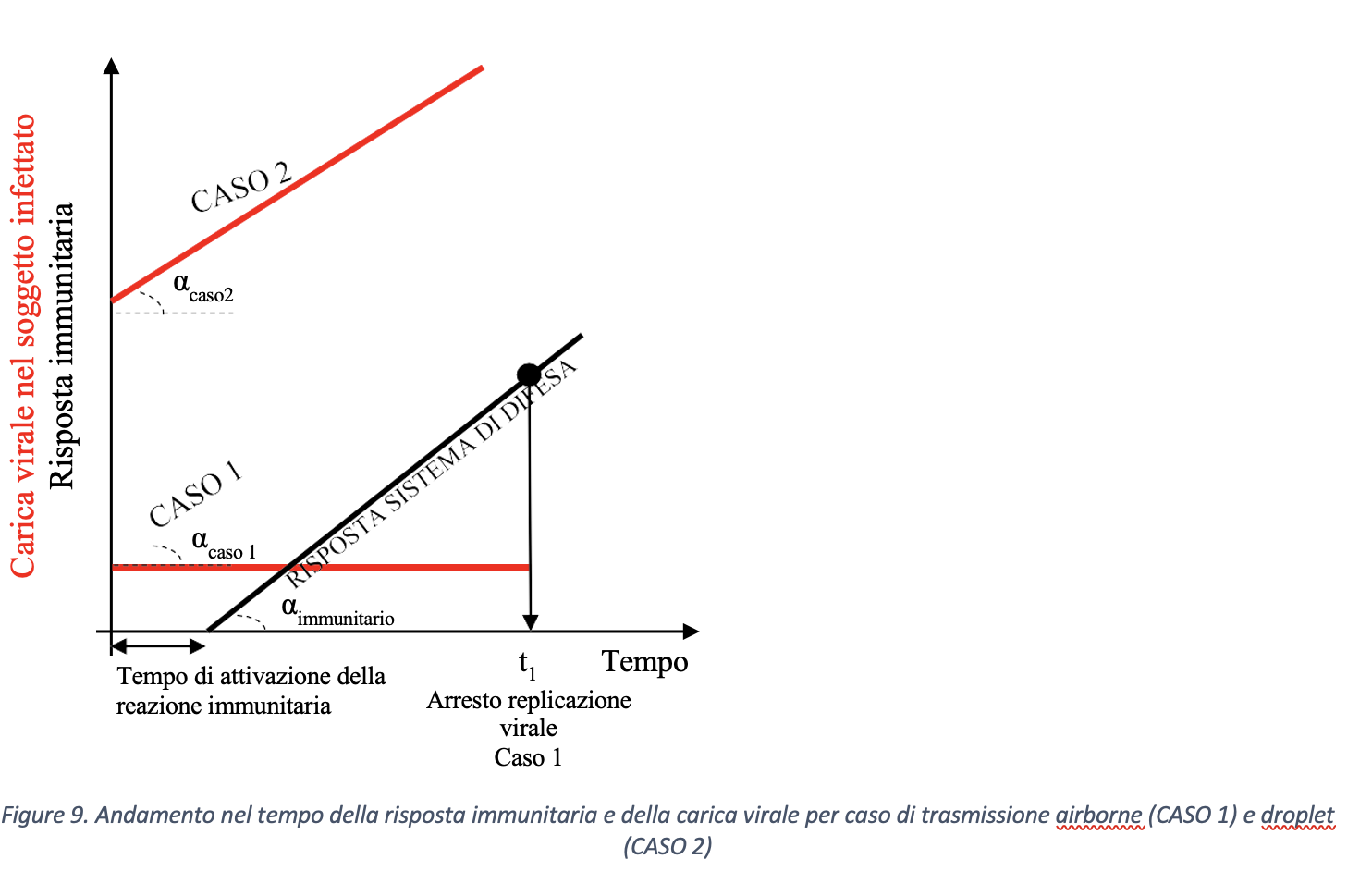
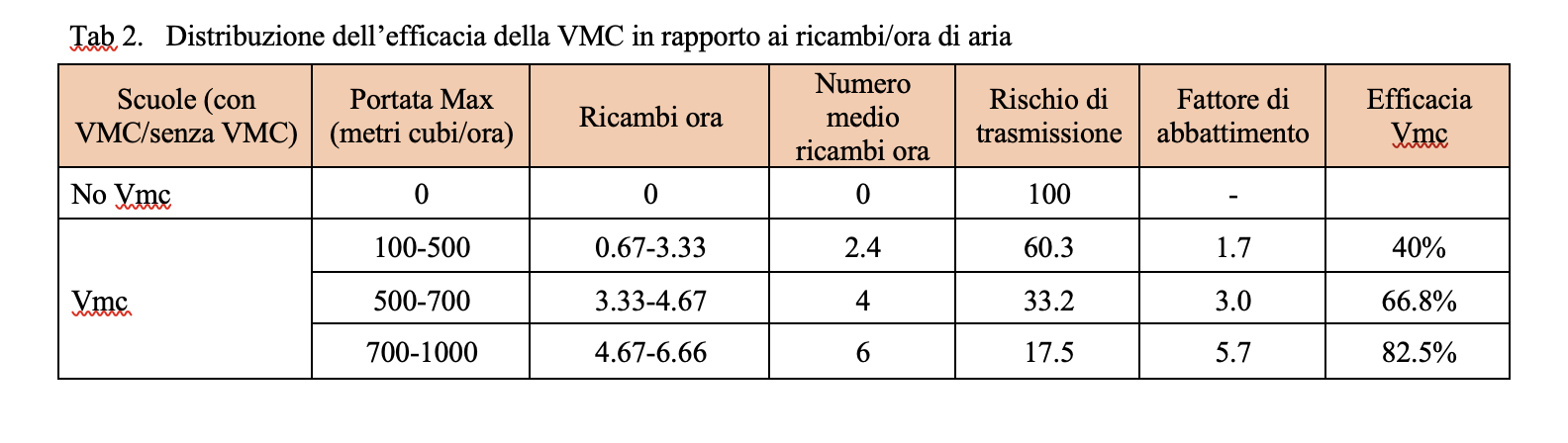
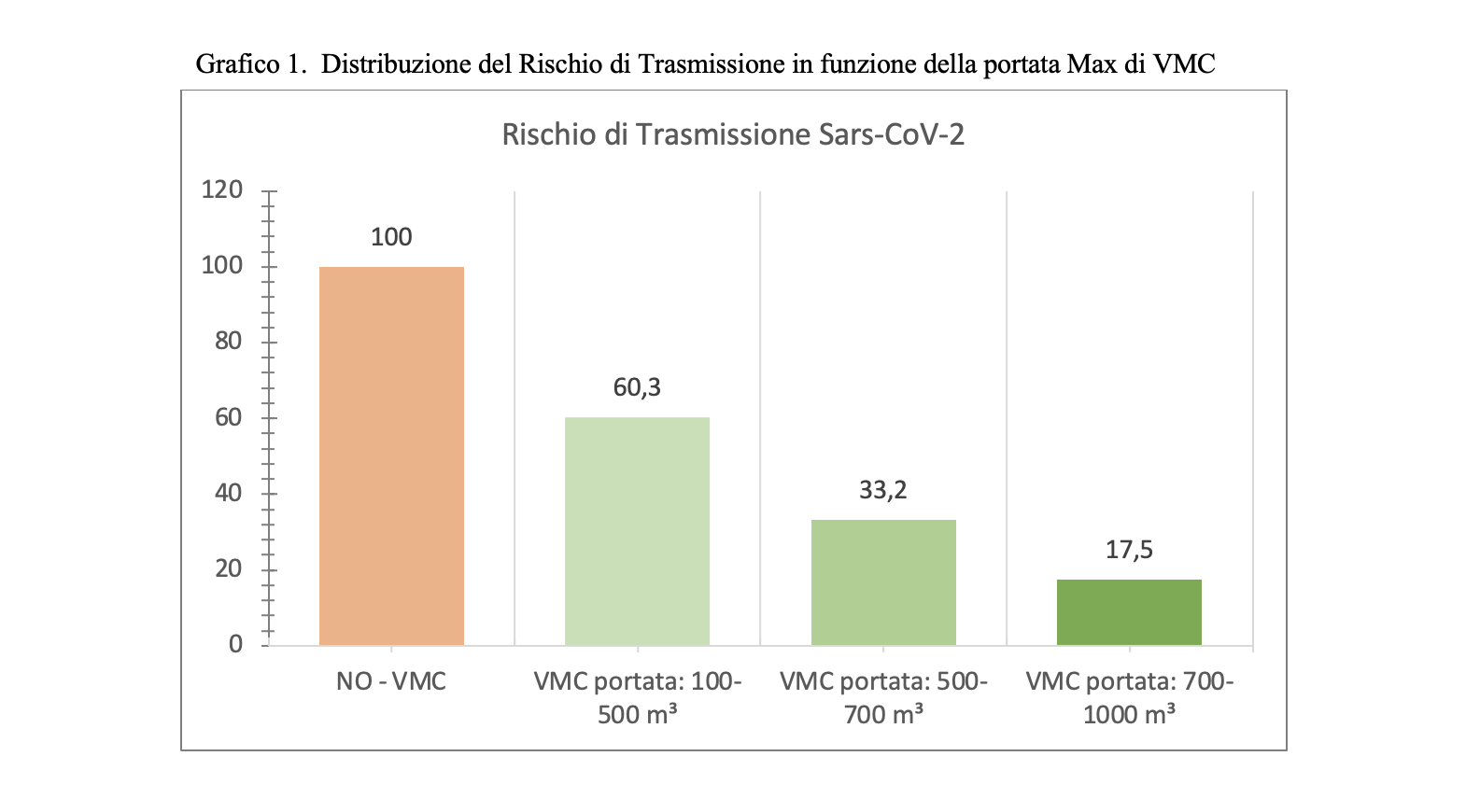
Sulla base delle considerazioni precedenti, l’angolo αcaso1 ,caso2 rappresenta la velocità di replicazione virale e, nel modello matematico presentato sembrerebbe essere funzione della concentrazione virale con la quale il soggetto target viene a contatto. Di conseguenza, a parità di tempi di risposta del sistema difensivo umano all’aumentare della concentrazione virale corrisponderebbe una maggiore velocità di replicazione virale. Dunque, tenuto conto del tempo di attivazione della risposta difensiva, all’aumentare della concentrazione virale, in soggetti con stessa risposta difensiva (stesso αimmunitario), corrisponderebbe una dilagazione dell’infezione virale maggiore. Pertanto, a parità di numero di virioni trasportati, le goccioline che a seguito di evaporazione vedono diminuire il loro volume e, al contrario, aumentare la propria concentrazione virale sono caratterizzate da una maggiore pericolosità in termini di capacità di trasmissione del contagio da SARS- CoV-2. In Tabella 2 si introduce una scala qualitativa di pericolosità delle modalità di trasmissione del virus SARS-CoV-2.
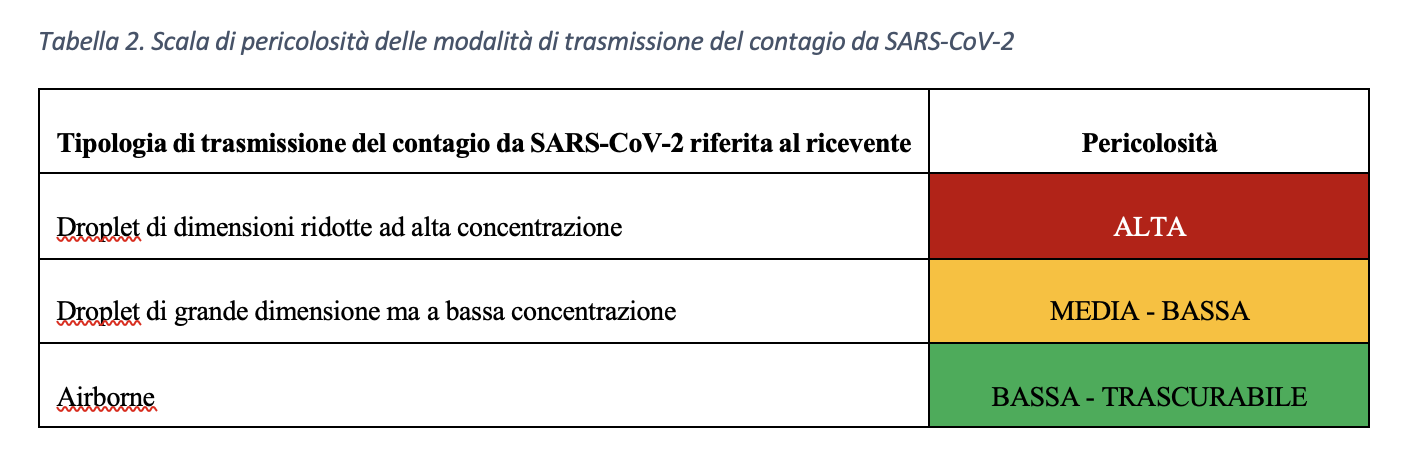
Sulla base delle considerazioni sin qui esposte risulta evidente l’importanza di studiare, quando si parli di trasmissione droplet, le goccioline all’atto dell’emissione per poi seguirne l’evoluzione fino all’eventuale contatto con il soggetto ricevente. In realtà le goccioline che raggiungono il bersaglio con diametro inferiore o uguale a 10 μm hanno, in un ambiente ad umidità controllata, un diametro ben maggiore all’emissione e, dunque, una concentrazione virale maggiore di quella che è presente nel soggetto infetto fonte di contagio. Le considerazioni proposte danno ragione alla classificazione di trasporto airborne e droplet inizialmente suggerita e ci consentono di affermare che il virus che “nasce” droplet, droplet deve rimanere per conservare la propria capacità infettiva.
6. Distribuzione dimensionale e concentrazione virale delle goccioline emesse con atto fonatorio e tosse da un soggetto infetto
Si consideri ora l’emissione di goccioline da parte di un soggetto infetto: per arrivare ad identificare la distanza di sicurezza, così come definita precedenza, ci si chiede quante delle goccioline emesse riescano a raggiungere il bersaglio e con quale concentrazione virale. Diviene quindi indispensabile effettuare delle valutazioni in merito alla distribuzione dimensionale (numero e dimensione) delle goccioline emesse, così come al loro contenuto di virioni.
Rispetto al primo punto, si assuma che le goccioline siano emesse per colpo di tosse e per attività fonatoria. Non sono quindi considerate, nel caso di studio, le emissioni di goccioline conseguenti, per esempio, a starnuti o durante la respirazione. Nella letteratura scientifica, sebbene siano stati effettuati numerosi studi al riguardo, si evidenzia come “i risultati siano fra di loro inconsistenti in virtù delle differenti metodologie e strumentazione utilizzata per lo scopo” (Han et al., 2015) come dimostrato dalla review di Rawlinson et al. (2010). Chi scrive, allo stato dell’arte, non ha strumenti ed informazioni tali da poter validare o confutare i dati proposti da vari autori e riportati in tabella 3 per attività fonatoria e in tabella 4 per colpo di tosse. Per esempio, con riferimento alle due tabelle Xie et al. (2009) identificano come intervallo predominante per fonazione e colpo di tosse l’intervallo dimensionale compreso fra [50 μm, 75 μm] mentre altri ricercatori, fra cui quelli del gruppo di Morawska et al. (2008), identificano tale intervallo per valori inferiori a 10 μm. Sulla base di tale inconsistenza, si ritiene necessario identificare un protocollo di prova standardizzato, rigoroso volto ad identificare univocamente la distribuzione dimensionale di goccioline di saliva/secrezioni emesse dall’essere umano durante le varie attività.
Dbouk & Drikakis, (2020) hanno interpolato i dati di Xie et al. (2009) relativi alla distribuzione dimensionale delle goccioline emesse per fonazione come riportati in Figura 10. In particolare, l’articolo citato stima pari a 760 il numero totale di gocce mediamente emesse per attività fonatoria da un soggetto che conta da 1 a 100 (quindi un’attività fonatoria continua di durata pari a circa un minuto e mezzo), rilevando il numero di gocce emesse sperimentalmente senza l’utilizzo di coloranti alimentari. L’articolo, tuttavia, riporta per alcuni soggetti un valore massimo di gocce pari a 2749.
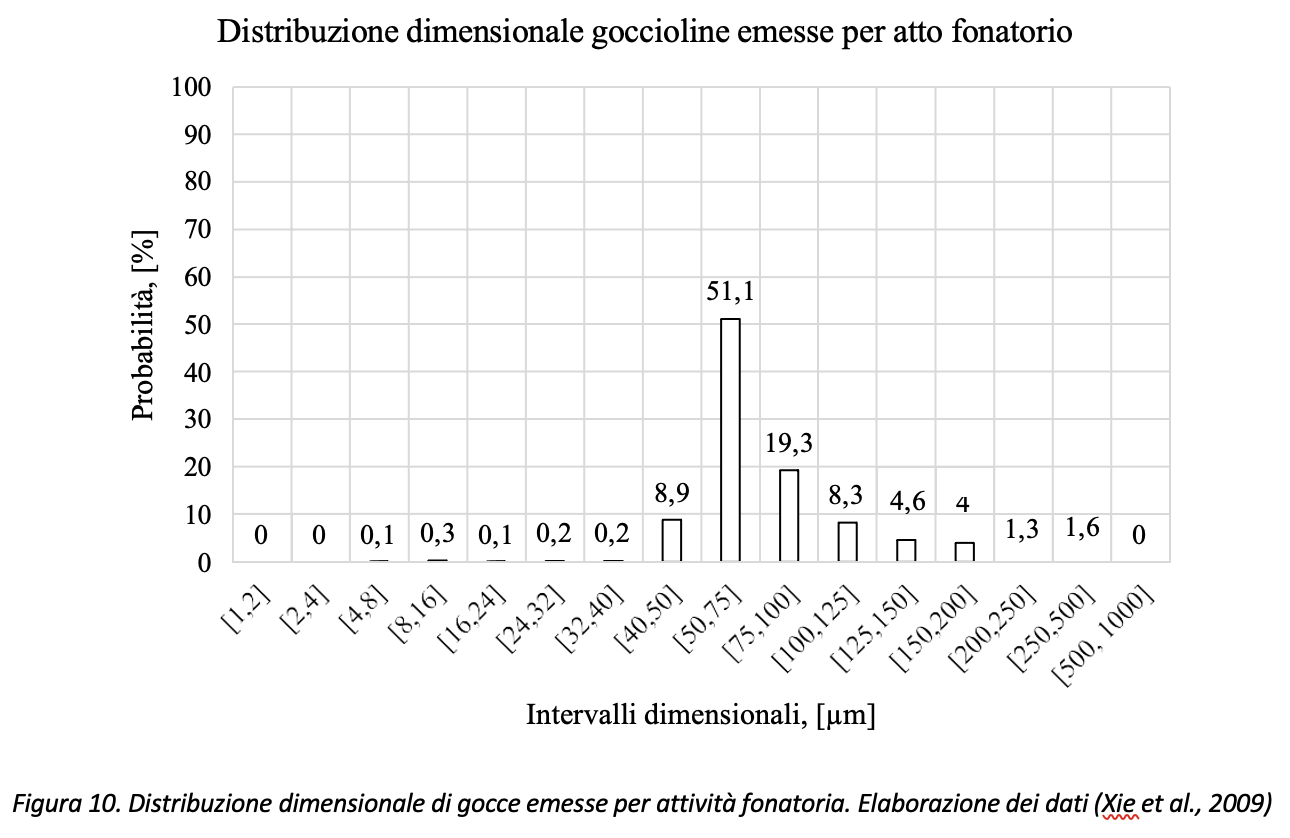
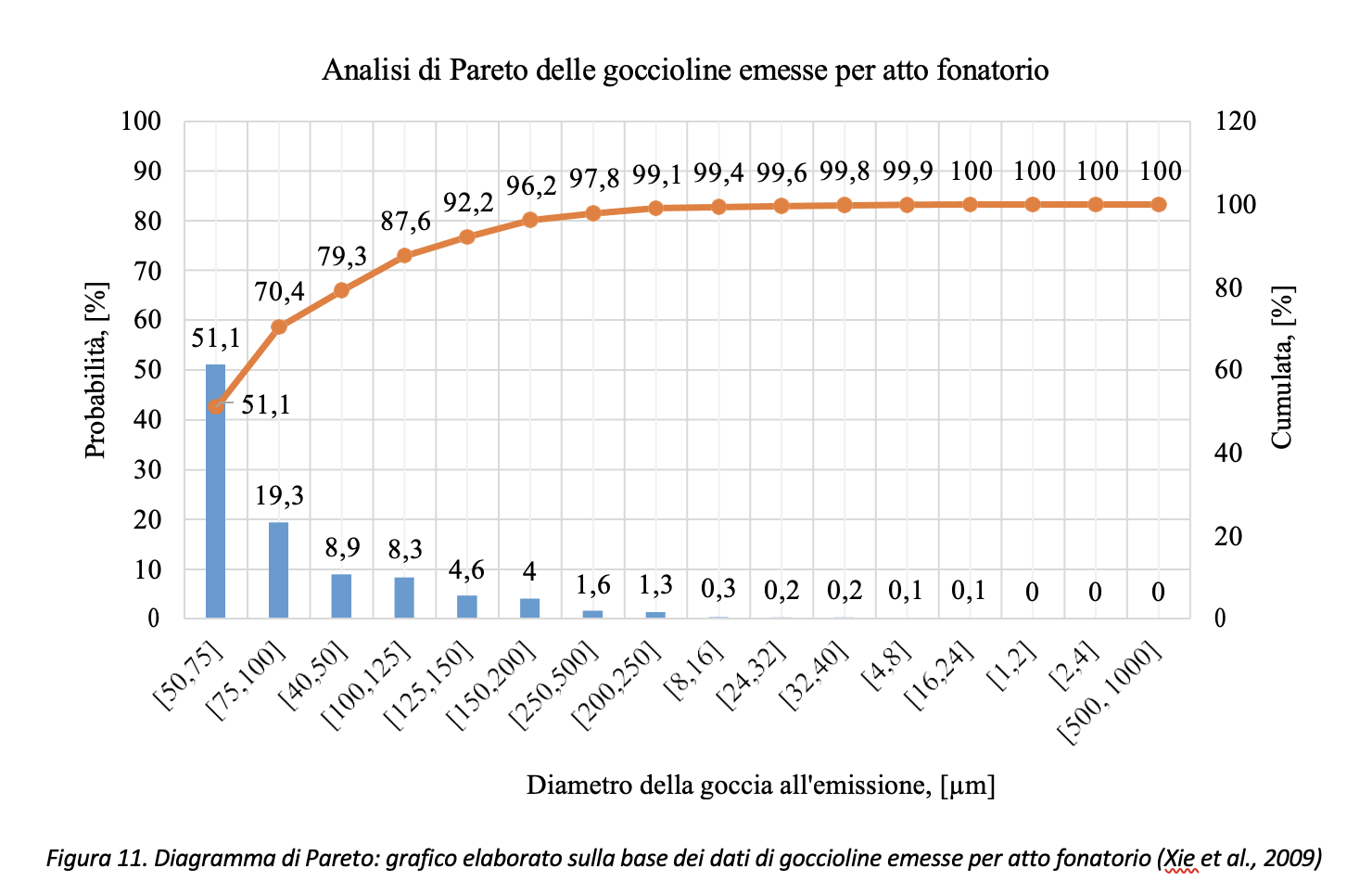
Volendo rappresentare i dati di Figura 10 con il diagramma di Pareto3, con riferimento ai dati di Xie et al., (2009), circa il 79% (=51.1+19.3+8.3) delle gocce emesse risulterebbe compreso nell’intervallo [50 µm, 125 µm] come risulta dai dati riportati in Figura 11.
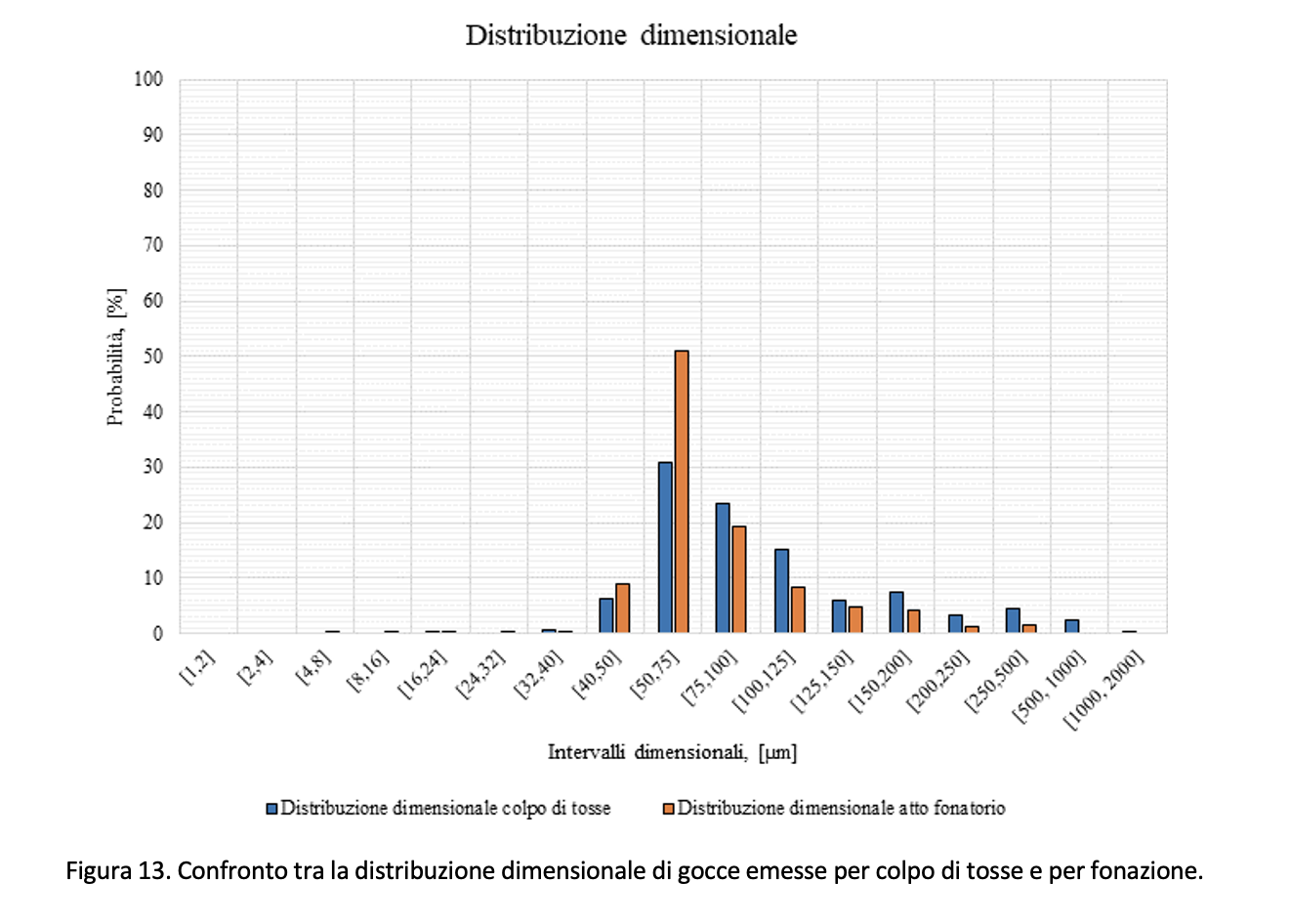
Relativamente al colpo di tosse si riporta in Figura 12 l’elaborazione dei dati come riportati da Xie et al. (2009). Rispetto all’atto fonatorio, l’articolo citato stima pari a 800 il numero totale di gocce mediamente emesse da un soggetto che tossisce 20 volte. L’articolo, tuttavia, riporta per alcuni soggetti un valore massimo pari a 1331 gocce. Anche in questo caso, i dati si riferiscono a prove in assenza di coloranti alimentari per la rilevazione delle gocce. Rispetto al caso di atto fonatorio, le goccioline emesse hanno dimensione, mediamente, più grande, come si può osservare dal confronto riportato in Figura 13.
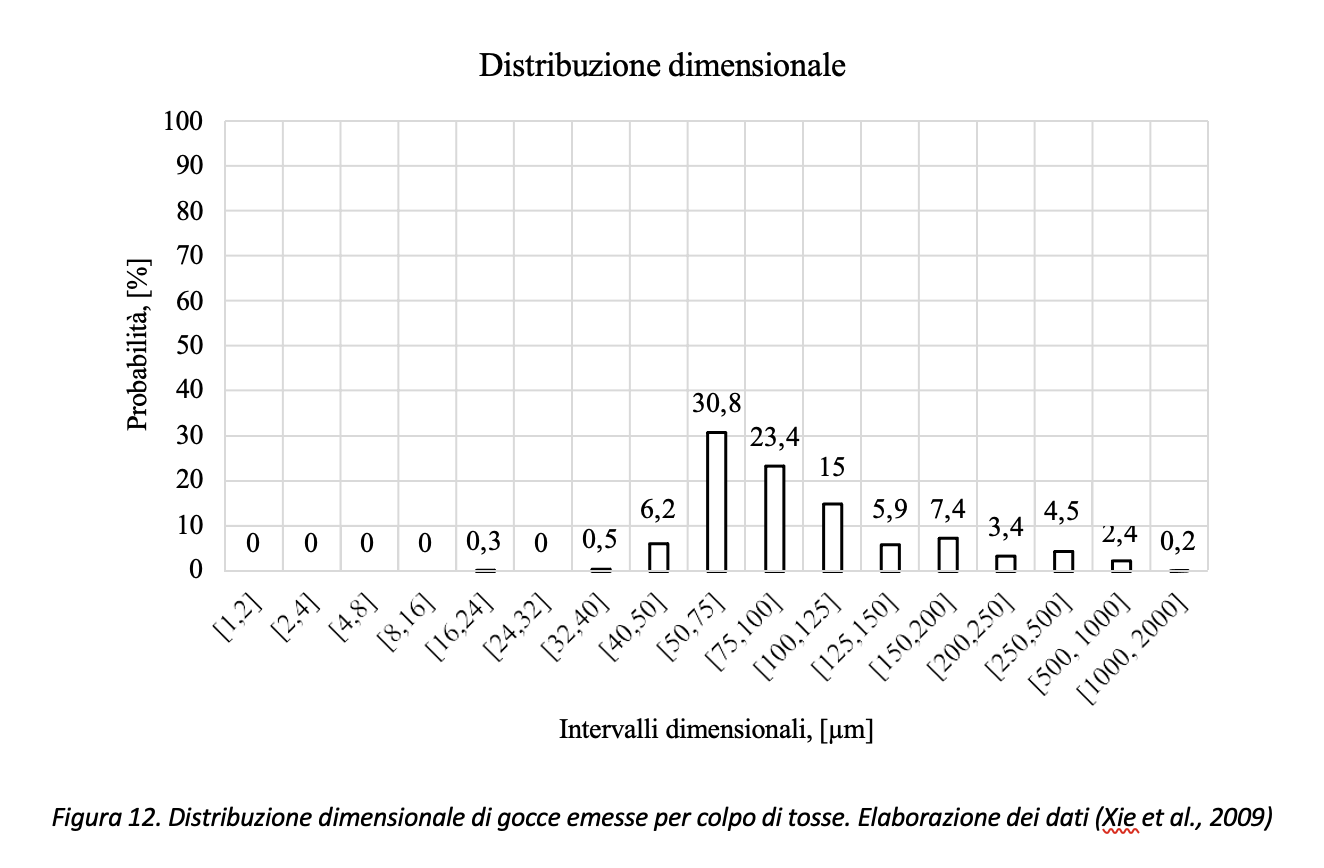
Volendo rappresentare i dati di Figura 12 con il diagramma di Pareto, con riferimento ai dati di Xie et al., (2009), circa il 77% (=30.8+23.4+15.0+7.4) delle gocce emesse risulterebbe compreso nell’intervallo [50 µm, 200 µm] come risulta dai dati riportati in Figura 14.
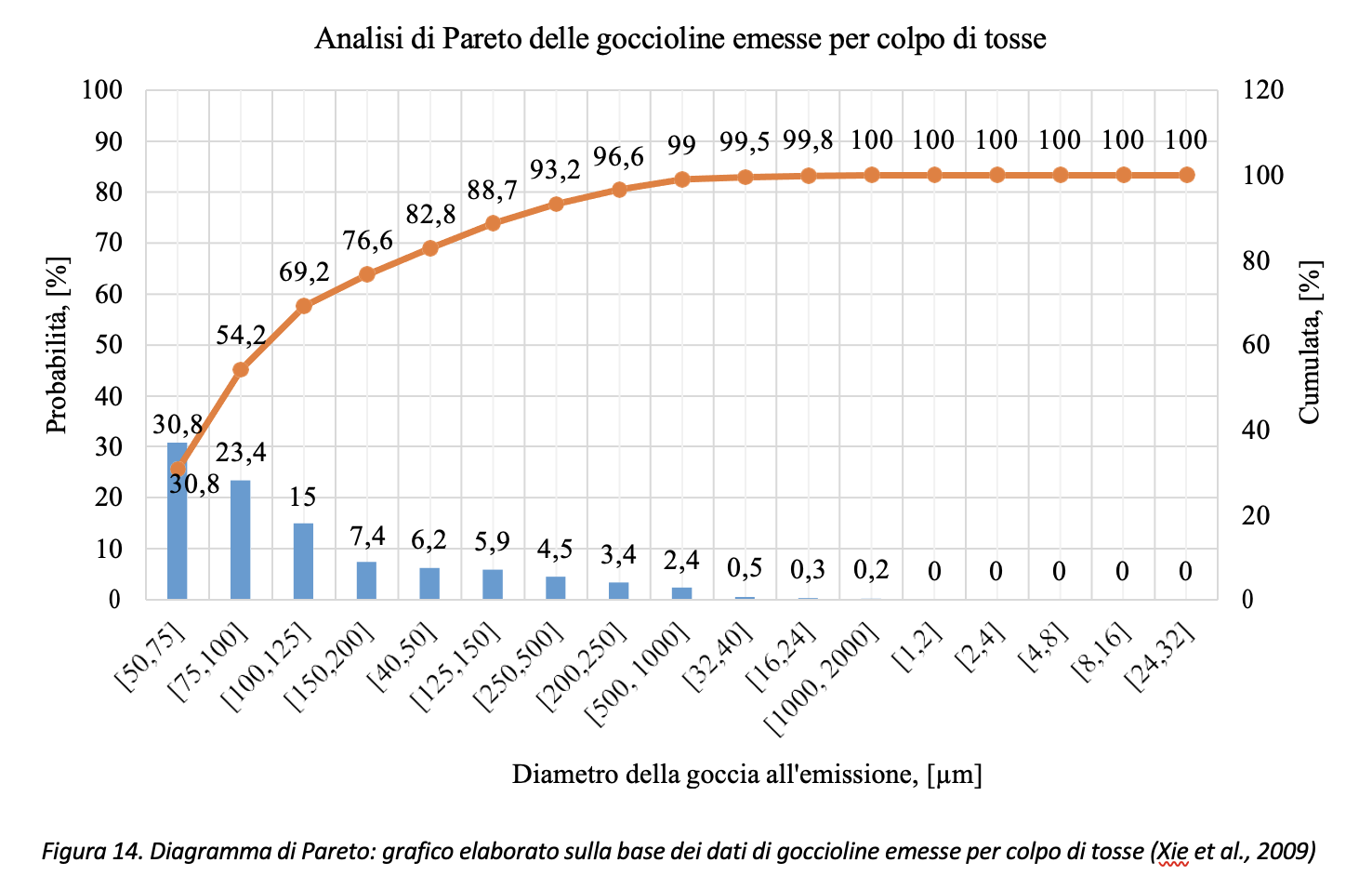
Il secondo parametro da tenere in considerazione per le valutazioni sulla distanza di sicurezza è la concentrazione virale nella secrezione liquida costituente le gocce emesse dal soggetto infetto. Tale valore presenta un’elevata variabilità rendendo quindi necessario, sulla base delle informazioni allo stato dell’arte, identificare un intervallo di valori. In particolare, Carlos Cordon-Cardo et al. (2020) riportano un valore medio misurato nei soggetti positivi pari a 105.6 virioni/mL mentre Kleiboeker et al. (2020), su un campione di 4428 soggetti risultati positivi al SARS-CoV-2, indicano come valore massimo e valore minimo di concentrazione virale rispettivamente pari a 1010.42 e 100.91 virioni /mL. A questo proposito occorre però sottolineare che le cariche virali presenti nelle secrezioni variano da soggetto a soggetto e in particolare nelle varie fasi di malattia, a partire dal periodo pre-sintomatico (Sethuraman at al., 2020). Per quanto riguarda i soggetti asintomatici e sintomatici, un altro lavoro molto recente di ricercatori italiani riferito alla esperienza di Vo’ Euganeo e pubblicato su Nature (Lavezzo et al., 2020) ha dimostrato che la carica virale è simile e dipendente dal tempo trascorso dall’inizio dell’infezione.
7. Valutazioni quantitative per l’identificazione della distanza di sicurezza dal punto di emissione
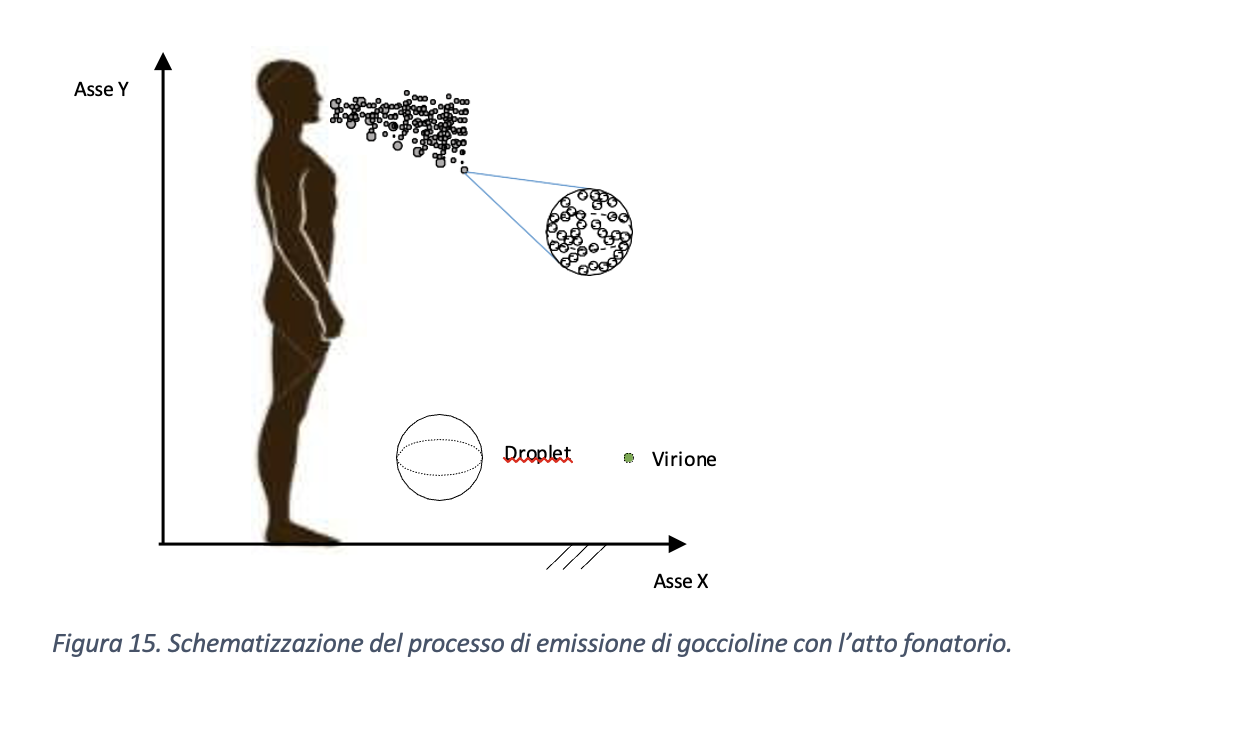
Per valutare la distanza di sicurezza al fine di minimizzare il rischio di contagio occorre considerare la gittata delle gocce emesse, ovvero la distanza alla quale queste possono arrivare una volta emesse da un individuo (Figura 15). L’elemento chiave per valutare la gittata è il tempo di persistenza della gocciolina emessa da un soggetto infetto nell’ambiente. Infatti, teoricamente, dopo un certo tempo, che dipende anche dalle dimensioni iniziali, la gocciolina sarà completamente evaporata oppure caduta al suolo prima di essere evaporata. Il tempo di permanenza in aria, dunque, è correlato alla traiettoria percorsa dalla gocciolina dopo essere stata emessa dal soggetto infetto. Tuttavia, al di fuori di condizioni controllate come quelle di laboratorio, non è semplice determinare nei casi reali sia il tempo di permanenza in aria che la distanza percorsa dalle goccioline.
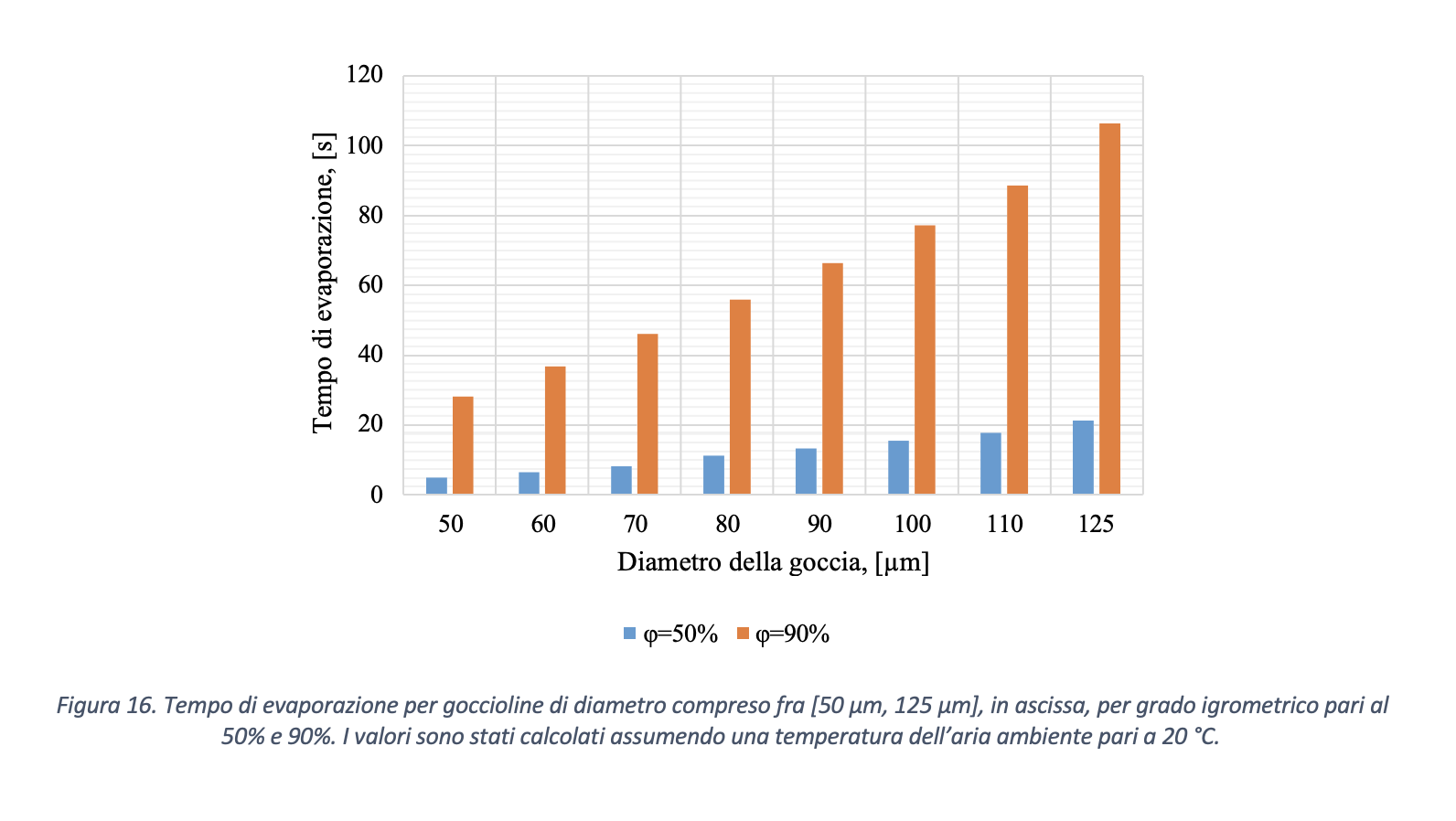
Assumendo valori per l’umidità relativa negli ambienti compresa fra RH=50% e RH=90%, in Figura 16 si sono calcolati i tempi necessari per la completa evaporazione delle goccioline con diametro iniziale compreso fra [50 µm, 125 µm], ovvero l’intervallo dimensionale predominante come supposto da Xie et al. (2009). Si ritiene che il valore di RH minimo pari al 50% sia ragionevole poiché scendendo al di sotto di tale limite si potrebbero verificare condizioni di discomfort termoigrometrico per gli occupanti dei locali.
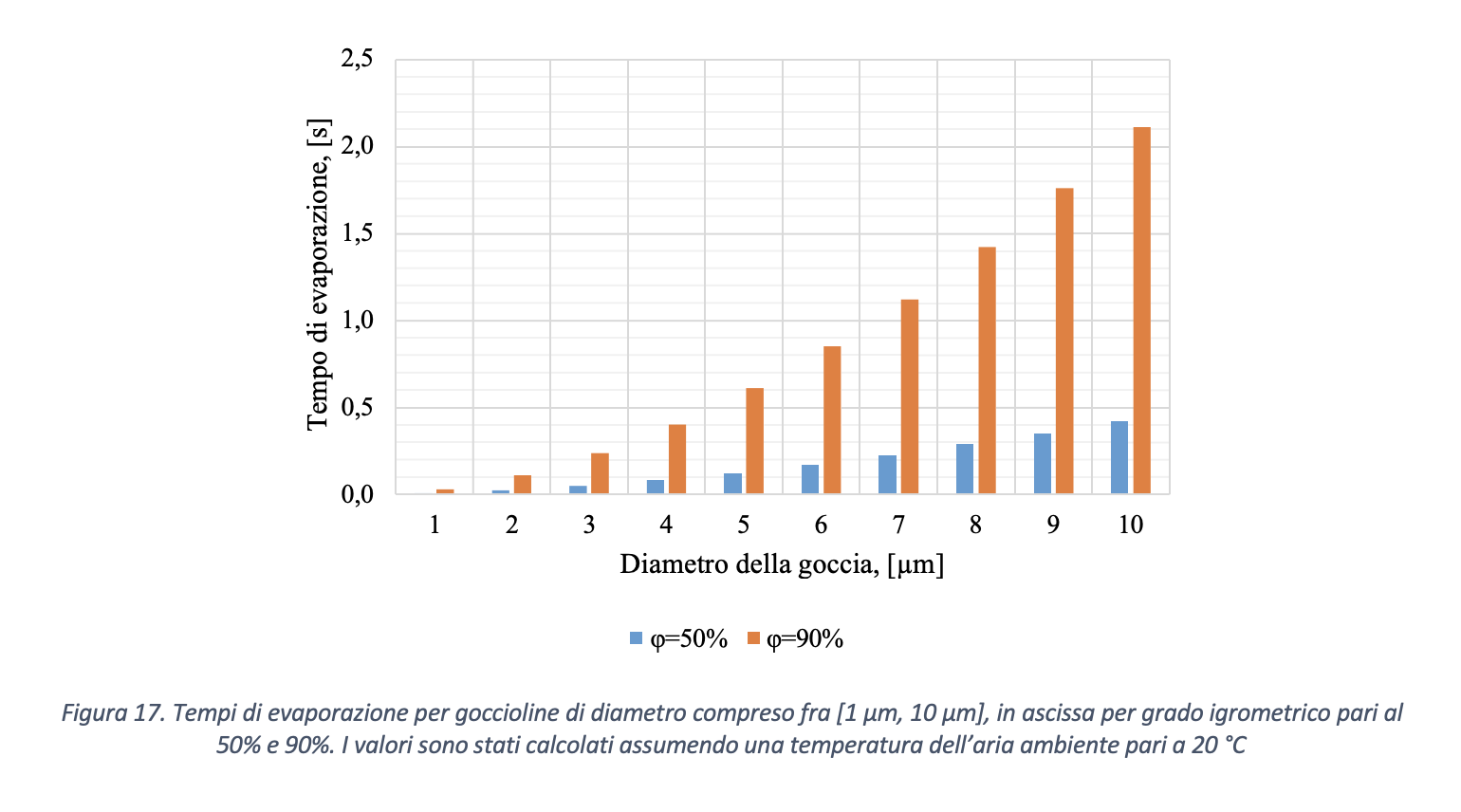
 Per utile comparazione del tempo di evaporazione ottenuto considerando l’intervallo predominante come indicato da Xie et al. (2007), si riportano in Figura 17 i tempi di completa evaporazione per goccioline di dimensione compresa fra [1µm, 10µm], ovvero il range di dimensioni che risulterebbe predominante così come ipotizzato da Morawska et al. (2009), Chao et al. (2009), Morawska et al. (2011). Come riportato in figura 17, i tempi di evaporazione risultano inferiori a 2.5 s, valore massimo calcolato nel caso di gocciolina di diametro iniziale pari a 10 μm e umidità ambiente pari al 90%. Pertanto nelle valutazioni seguenti, in virtù dell’inconsistenza dei risultati sulla granulometria delle gocce riportata in letteratura, a beneficio di sicurezza si considera il caso di distribuzione dimensionale per le gocce emesse in accordo a Xie et al. (2009).
Per utile comparazione del tempo di evaporazione ottenuto considerando l’intervallo predominante come indicato da Xie et al. (2007), si riportano in Figura 17 i tempi di completa evaporazione per goccioline di dimensione compresa fra [1µm, 10µm], ovvero il range di dimensioni che risulterebbe predominante così come ipotizzato da Morawska et al. (2009), Chao et al. (2009), Morawska et al. (2011). Come riportato in figura 17, i tempi di evaporazione risultano inferiori a 2.5 s, valore massimo calcolato nel caso di gocciolina di diametro iniziale pari a 10 μm e umidità ambiente pari al 90%. Pertanto nelle valutazioni seguenti, in virtù dell’inconsistenza dei risultati sulla granulometria delle gocce riportata in letteratura, a beneficio di sicurezza si considera il caso di distribuzione dimensionale per le gocce emesse in accordo a Xie et al. (2009).
Valutare la gittata teorica è comunque fondamentale per identificare un riferimento oggettivo, utile per identificare un valore della distanza di sicurezza oltre alla quale è possibile ritenere improbabile il rischio di contagio. Per determinare la gittata teorica di goccioline non soggette a moti browniani occorre impostarne l’equazione del moto e, dunque, effettuare il bilancio delle forze che agiscono su di essa: i) forza di gravità (Fgrav), ii) forza di galleggiamento o spinta idrostatica (Flift) e iii) forza resistente del fluido (cioè l’aria) che si oppone al moto della particella (Fres). Assumendo la gocciolina come una sfera di diametro all’emissione dg, valgono le equazioni vettoriali 8, 9 e 10:
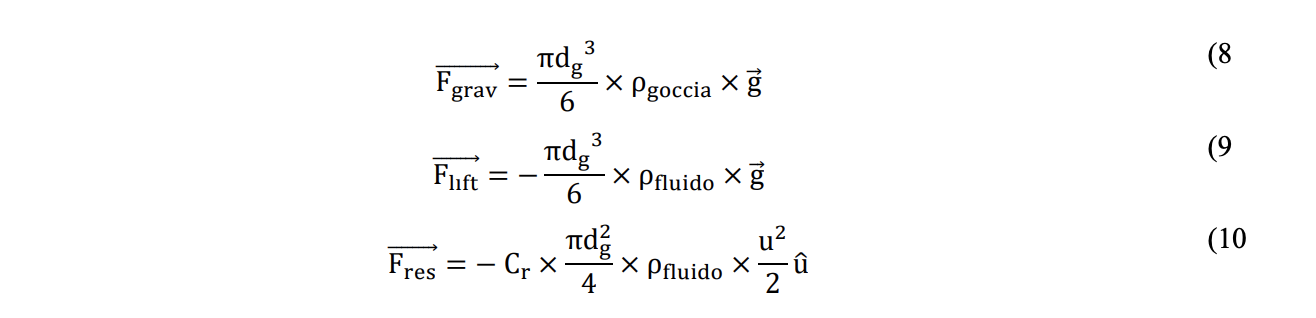
Dove ρgoccia e ρfluido sono, rispettivamente, la densità della gocciolina e del fluido all’interno del quale si muove la gocciolina (kg/m3), g è l’accelerazione di gravità pari a 9.81 m/s2, Cr è un coefficiente adimensionale che dipende dal parametro Res (Reynolds del solido/liquido), u è la velocità relativa della particella rispetto al fluido in cui si muove (m/s), mentre 𝑢̂ è il versore del vettore velocità. Il parametro adimensionale Res è calcolato in accordo all’equazione 11:
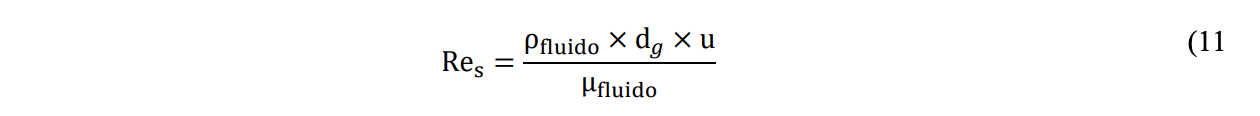
dove μfluido è la viscosità dinamica del fluido in cui si muove la gocciolina (Pa s).
La legge del moto della gocciolina si scrive in accordo all’equazione 12, dove mgoccia è la massa della gocciolina ed 𝑎→ è il vettore accelerazione della gocciolina.
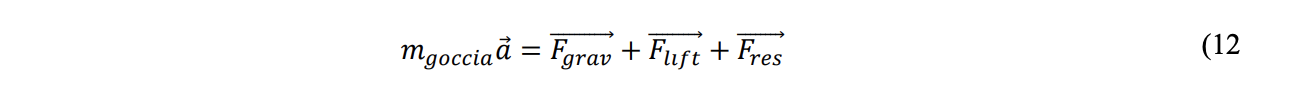
Inoltre, la risoluzione della legge del moto deve tener conto del processo di evaporazione che determina una variazione del volume della gocciolina, quindi del diametro, nel tempo in funzione delle condizioni termoigrometriche dell’ambiente, quali i) temperatura e ii) umidità relativa.
Data la complessità legata alla risoluzione del problema, si assume, in accordo al modello proposto da Xie et al. (2007), che i) l’emissione di goccioline avvenga assieme all’emissione di una corrente di aria che si suppone alla stessa velocità assiale (orizzontale) delle goccioline e che ii) tale emissione possa essere schematizzata come un jet non-isotermo. In particolare, il jet può essere definito come il cono il cui vertice ed il cui asse di simmetria coincidono, rispettivamente, con il punto e con la direzione di emissione e la cui equazione parametrica è definita in accordo alla metodologia proposta nell’articolo citato.
Le considerazioni seguenti saranno valide per il caso di colpo di tosse. In particolare, da Figura 18 in avanti la superficie esterna del jet, calcolato per velocità di lancio delle goccioline pari a 10 m/s, ovvero tipiche di un colpo di tosse, è evidenziata in blu. Inoltre, le valutazioni fanno riferimento alle seguenti condizioni ambientali: temperatura dell’aria pari a 20 °C e umidità dell’aria pari a RH=50%. Analizzando la Figura 18, si deduce che:
- Le gocce che vengono emesse con diametro uguale o maggiore di 100 µm non evaporano completamente prima di aver raggiunto il In particolare, una volta che la goccia sia fuoriuscita dal jet la componente di moto orizzontale è praticamente nulla;
- Le gocce che vengono emesse con diametro pari a 40 µm sono quelle che percorrono la distanza orizzontale maggiore prima di scomparire per evaporazione (a circa 2.2 m dal punto di emissione) e che permangono ad altezza elevata.
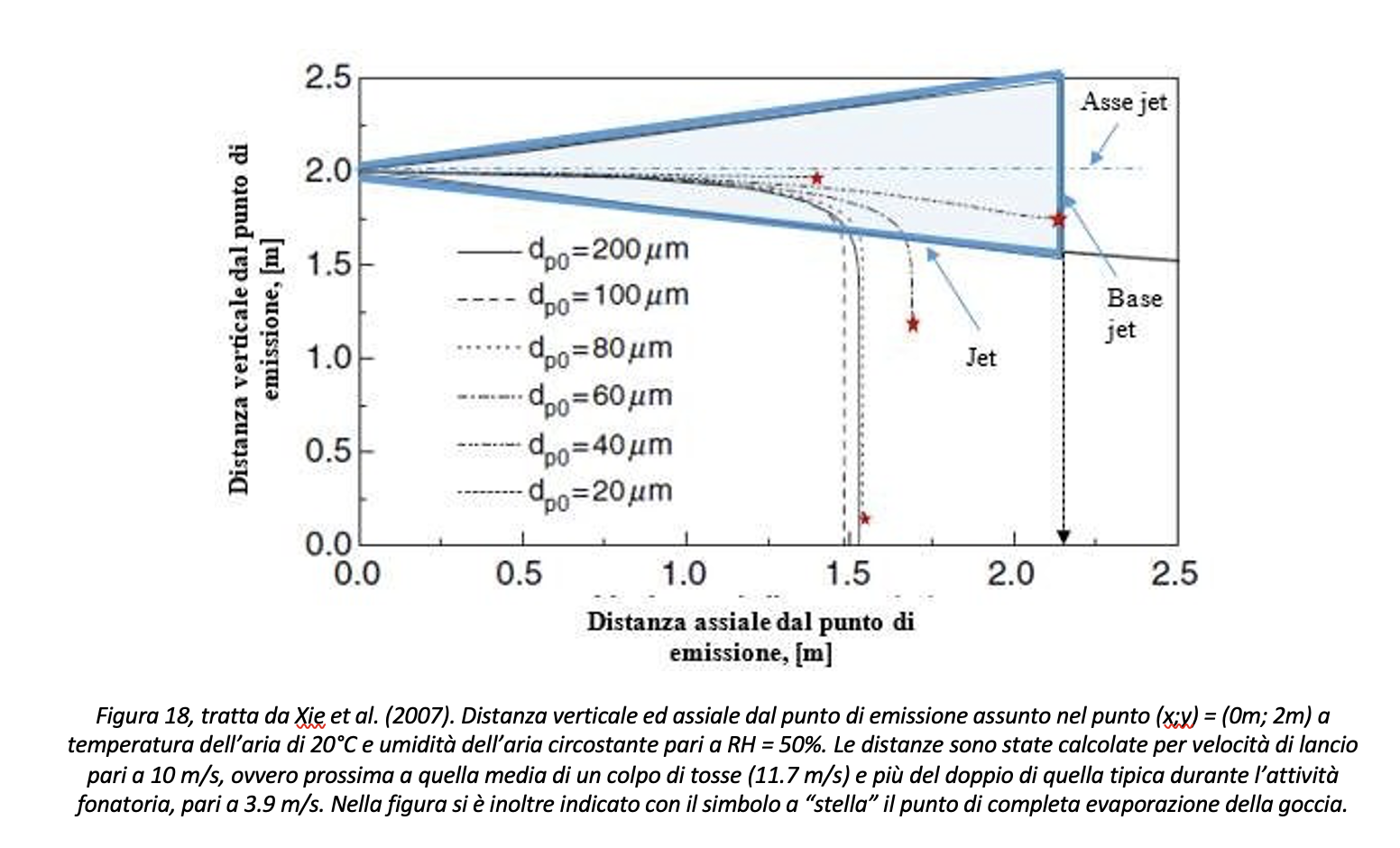
Partendo dai risultati riportati in Figura 18, per le valutazioni seguenti si assume:
- L’emissione delle goccioline per colpo di tosse può essere descritta con la distribuzione dimensionale proposta da Xie et (2009) e mostrata in Figura 12. Si ricorda che la distribuzione dimensionale utilizzata per le valutazioni seguenti è riferita a 20 colpi di tosse.
- La concentrazione virale della secrezione liquida è considerata come riportato nel precedente
- Il volume di aria all’interno del cono di emissione di altezza pari a 2 m e raggio di base 0.5 m (volume in blu nella Figura 18) risulta pari a 5.8 x 105 mL.
- Le goccioline di diametro all’emissione superiore a 60 µm fuoriescono dal cono di emissione prima di essere completamente evaporate. Pertanto, i virioni in esse contenuti, qualora rilasciati prima di aver raggiunto il suolo, non contribuiscono all’aumento della concentrazione virale all’interno del cono di
Si valutano allora i tre casi seguenti:
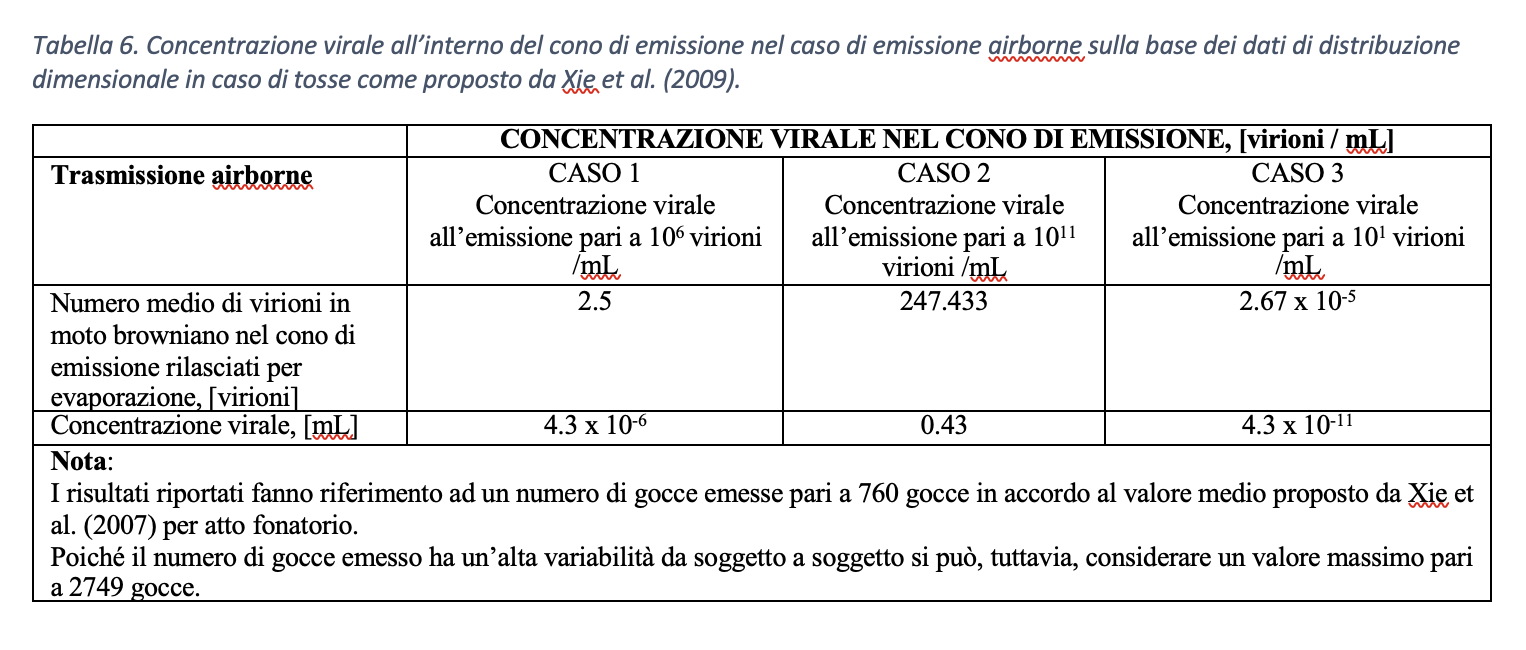
CASO 1. La secrezione liquida emessa dal soggetto infetto ha concentrazione virale media pari a 106 virioni/mL:
- Trasmissione droplet. Rielaborando i dati di Xie at al. (2009) relativi alla distribuzione dimensionale delle gocce emesse risulta che il 2% del totale, quindi circa 50 gocce su 800, ha diametro compreso fra [40 µm, 50 µm]. Tali gocce, come mostrato in Figura 18, sono quelle caratterizzate dalla maggiore gittata e, dunque, sono potenzialmente le più pericolose. Sulla base della concentrazione virale assunta all’emissione, le gocce emesse con diametro iniziale pari a 40 µm possono veicolare 0.034 virioni/goccia. Pertanto, su 30 gocce emesse, in media solamente una goccia contiene un virione. Le gocce emesse con diametro iniziale pari a 60 µm, invece, possono veicolare 0.113 virioni/goccia, ovvero su 9 gocce emesse, mediamente, solo una contiene un virione. Viceversa, le gocce che all’emissione presentano un diametro compreso fra [60 µm, 125 µm] costituiscono il 62.6% del totale, quindi 476 gocce su un totale di 800. Sulla base della concentrazione virale all’emissione, le gocce emesse con diametro iniziale pari a 125 µm possono veicolare 1.02 virioni/goccia, ovvero ogni goccia emessa contiene in media un virione.
- Trasmissione airborne. I virioni rilasciati a seguito di evaporazione delle goccioline e soggetti a moti browniani si diffondono in tutto il volume di controllo. In particolare, il numero di virioni rilasciato a seguito di evaporazione delle gocce all’interno del volume di controllo è pari a 2.5 virioni nel caso di emissione di 800 goccioline. La concentrazione virale veicolata in modalità airborne all’interno del cono di controllo (che, giova ricordare, ha volume pari a 8 x 105 mL) risulta pari a 4.3 x 10-6 virioni/mL.
Rispetto all’ultimo punto occorre sottolineare che il basso indice di pericolosità per la modalità di trasmissione airborne, come proposto in tabella 2, è giustificabile in quanto:
- i virioni, soggetti a moti browniani, si diffondono in tutto il volume di controllo dando luogo a concentrazioni virali relativamente basse rispetto al caso di trasporto Infatti, nonostante sia ragionevole pensare che solo una parte delle goccioline emesse dal soggetto infetto raggiunga il soggetto suscettibile, la probabilità di contagio tramite droplet è maggiore in virtù dei meccanismi di urto o impatto con le superfici respiratorie come precedentemente descritto.
- proprio grazie ai moti browniani, la probabilità di deposizione sulle superfici interne dell’organismo dei virioni veicolati in modalità airborne è ulteriormente diminuita dal momento che si può supporre come solo una piccola parte di virioni si vada a depositare nelle vie aeree del soggetto ricevente.
CASO 2. La secrezione liquida emessa dal soggetto infetto ha concentrazione virale massima nell’intervallo considerato, ovvero pari a 1011 virioni/mL:
- Trasmissione droplet. Sulla base della concentrazione virale all’emissione, il numero di virioni mediamente veicolato per singola goccia di diametro iniziale pari a 40 µm risulta circa 3351 virioni/goccia, raggiungendo il valore di 11310 virioni/goccia per gocce di diametro pari a 60 µm.
- Trasmissione airborne. Sulla base delle ipotesi precedenti, il numero di virioni rilasciato a seguito di evaporazione delle gocce all’interno del volume di controllo è pari a 247.433 virioni nel caso di emissione di 800 goccioline. La concentrazione virale all’interno del cono di emissione, nel caso di concentrazione virale all’emissione massima, risulta 43 virioni/mL, ovvero 1 virione ogni 2.3 mL.
CASO 3. La secrezione liquida emessa dal soggetto infetto ha concentrazione virale minima, ovvero pari a 101 virioni/mL:
- Trasmissione droplet. Sulla base della concentrazione virale all’emissione, il numero di virioni mediamente veicolato per singola goccia di diametro iniziale pari a 40 µm risulta circa 35 x 10-7 virioni/goccia, ovvero su 2.985.075 gocce emesse, mediamente solo una contiene un virione. Nel caso di diametro iniziale pari a 60 µm risulta un valore pari a 1.13 x 10-6 virioni/goccia, ovvero su 884.956 gocce solo una contiene un virione. Nel caso di diametro iniziale di 125 µm è calcolato un valore di 1.02 x 10-5 virioni/goccia, ovvero su 98.039 gocce, statisticamente, solo una contiene un virione.
- Trasmissione airborne. Sulla base delle ipotesi precedenti, il numero di virioni rilasciato nel volume di controllo a seguito di evaporazione delle gocce emesse per tosse, così come descritto dal protocollo di Xie et (2009), risulterebbe pari a 2.47 x 10-5 virioni nel caso di emissione di 800 goccioline. La concentrazione virale all’interno del cono di emissione, nel caso di concentrazione virale all’emissione minima, risulta 4.3 x 10-11 virioni/mL, ovvero 1 virione ogni 23.256 m3.
Si sintetizzano in tabella 5 e in tabella 6 i risultati ottenuti combinando le due modalità di trasporto del virus con tre differenti cariche virali del soggetto infetto nel caso di tosse.

Sulla base delle considerazioni sin qui esposte, possiamo ulteriormente avvalorare il modello già noto nelle modalità di trasmissione delle malattie infettive che vede in gioco una triade: il microrganismo (vie di eliminazione da parte del soggetto infetto e modalità di ingresso nel soggetto suscettibile, carica infettante, capacità replicativa, etc.); il soggetto target (caratteristiche del soggetto, età, genere, stato del sistema immunitario, patologie concomitanti, etc.) e ambiente (caratteristiche fisico-chimiche, etc.) (Rothman, 1976). In particolare, il soggetto infetto da SARS-CoV-2 la cui secrezione orale è caratterizzata dalla concentrazione virale massima, ovvero 1011 virioni/mL potrebbe avere un elevato potenziale infettante rispetto ad un soggetto suscettibile posto ad una distanza inferiore alla distanza di sicurezza. Le caratteristiche del soggetto bersaglio nonché le caratteristiche ambientali, devono comunque essere tenute in considerazione, Dalla combinazione di questi fattori possiamo cercare di capire come si diffonda nelle comunità l’infezione con vari gradi di severità. Pujadas et al. (2020), per esempio, dimostra come la carica virale sia un predittore di mortalità nei pazienti gravi e ospedalizzati. Il modello di diffusione di SARS-CoV-2 in realtà non è un modello deterministico, ma risponde a logiche probabilistiche e gli stessi input non producono sempre gli stessi output. Queste modalità sono evidenziate anche da numerosi casi di studio empirici che mettono in evidenza come nei confronti di SARS-CoV-2 possano esistere individui “superspreader” e eventi “superspreading” a differenza che per altre malattie virali, quali l’influenza, che seguono modelli più di tipo deterministico. Questa modalità di diffusione attraverso cluster è già stata descritta per MERS e SARS-CoV-1, ma sembra ancora più evidente per SARS-CoV-2. Numerose modellizzazioni matematiche affiancate da dati empirici, mostrano come l’80% dei casi secondari dipenda da meno del 20% dei soggetti infetti (Endo et al., 2020). La carica virale e le modalità comportamentali del soggetto infetto e del soggetto target, nonché le loro caratteristiche individuali, potrebbero spiegare perché un soggetto si comporta diversamente da un altro, ma le situazioni ambientali, comprese le distanze fra gli individui, le condizioni termo-igrometriche soprattutto in ambienti confinati potrebbero rendere ragione della restante parte della diffusione per gruppi. La maggior parte dei casi di cluster riportati in letteratura è avvenuta in ambienti indoor, scarsamente ventilati, in cui un gran numero di persone si è radunato per un periodo di tempo prolungato, come per esempio nel caso di cerimonie religiose, palestre, ristoranti, ambienti di lavoro confinati e senza distanziamento sociale (esempio il caso relativo ad un call center a Seul) (Jeong et al., 2020) (Kupferschmidt, 2020). In particolare, alcuni setting sono stati collegati con maggiore frequenza a eventi di superspreading, tra i quali dormitori e impianti di processazione della carne in USA e Nord Westfalia-Germania (bassa temperatura, alta umidità relativa e sovraffollamento) (). Inoltre, alcune attività sono state evidenziate come a più alto rischio, quali parlare ad alta voce (tifosi negli stadi) o cantare (come ad esempio nel caso dei cori (Hamner et al., 2020)). Qui vale la pena di sottolineare come a tutte le situazioni descritte corrisponda una condizione ambientale ad altissimo grado igrometrico RH.
D’altro canto invece, per quanto riguarda sia la concentrazione virale minima che quella media misurata in soggetti positivi al SARS-CoV-2, ovvero 101 virioni/mL e 106 virioni/mL, rispettivamente, sulla base dei risultati sopra esposti è lecito esprimere qualche dubbio sulla reale capacità di trasmissione del contagio, così come sull’impatto del virus sul soggetto eventualmente contagiato. Come già detto, ed in accordo con il modello rappresentato in Figura 9, le basse concentrazioni virali dovrebbero permettere al sistema immunitario di reagire con velocità relativamente alta rispetto a quella di propagazione del contagio, interrompendo in tal modo la replicazione virale in tempi brevi. Questo fenomeno trova spiegazione nel fatto che una maggiore concentrazione virale porta a ridurre la distanza media fra cellula e virione, e quindi i contatti, a parità di velocità del moto del virione che incontra la cellula, avvengono in tempi più brevi e, verosimilmente, inversamente proporzionali alla concentrazione stessa.
Sulla base delle precedenti considerazioni ed evidenze da casi di studio si può giustificare la presenza di sia di eventi superspreading sia di soggetti “Super- Spreader”, ovvero di soggetti positivi al SARS-CoV-2 in grado di infettare un numero elevato di soggetti suscettibili come ad esempio riportato nello studio di Zheng et al. (2020) in cui, in condizioni favorevoli, un solo soggetto sembrerebbe aver infettato il 33% delle persone con cui era venuto a contatto, una percentuale circa 5 volte superiore all’indice di trasmissione medio riscontrato nella stessa città.
Con riferimento alla Figura 18, la distanza per evitare la diffusione del contagio fra soggetto infetto e soggetto ricevente nel caso di colpo di tosse dovrebbe essere assunta almeno pari a 2.2 metri. La distanza di sicurezza così definita si riferisce a specifiche condizioni termoigrometriche, ovvero temperatura dell’aria pari a 20 °C e umidità relativa RH pari al 50%. Dalle considerazioni sul tempo di evaporazione al variare del grado igrometrico discende in maniera molto chiara come il controllo del grado igrometrico RH assuma un ruolo decisivo nel calcolo della distanza assiale che le goccioline riescono a percorrere, e quindi della determinazione della distanza di sicurezza. Si riportano in Figura 19 i casi calcolati da Xie et al. (2007) per goccioline da 20 µm e 40 µm per tre diversi valori del grado igrometrico in ambiente. Il risultato conferma come, con particolare riferimento alle goccioline di 20 µm, il controllo dell’umidità relativa in ambiente garantisca una minore distanza percorsa dalla gocciolina prima della sua completa evaporazione, ovvero al passaggio da trasmissione droplet ad airborne.
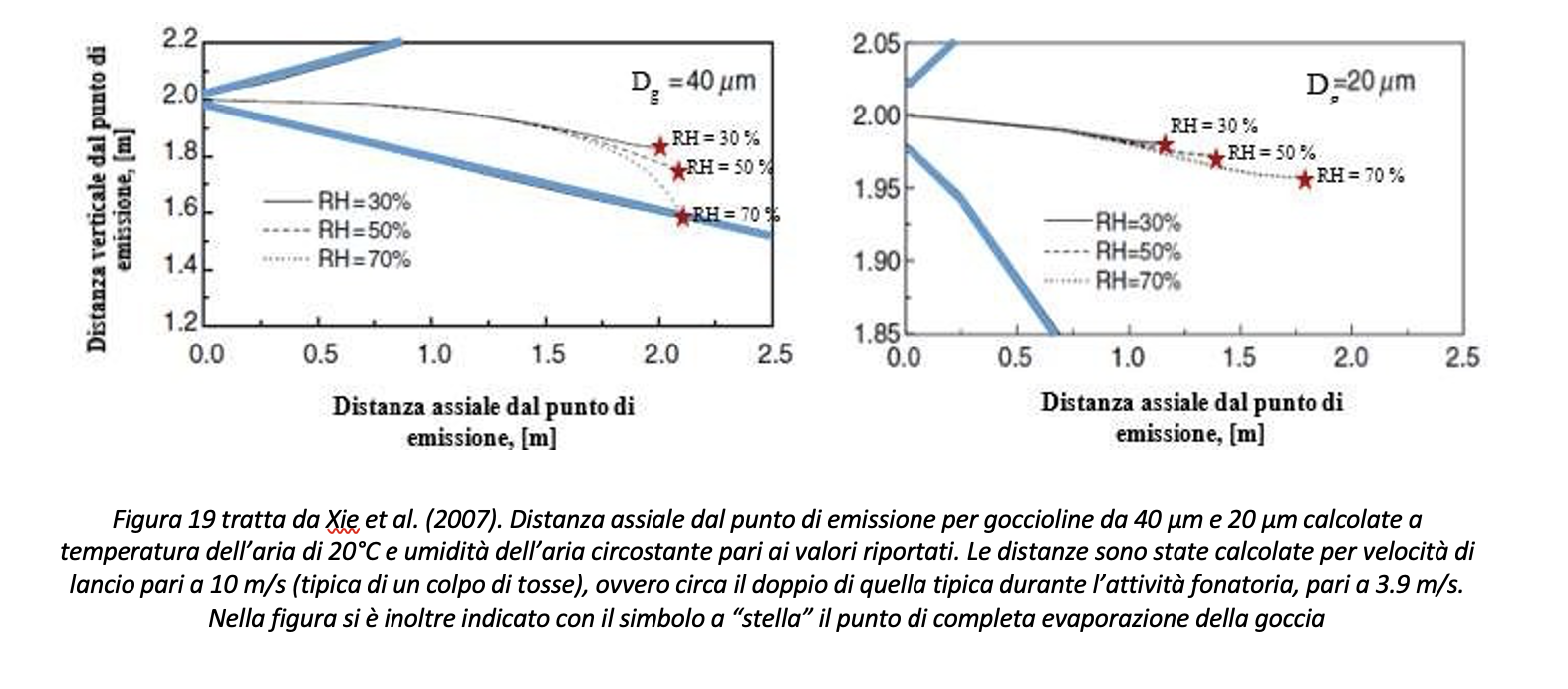
Sulla base del fatto che la relazione fra gittata di una goccia evaporante, temperatura ambiente, umidità relativa ambiente e velocità di lancio non è lineare, ma dipende dalla risoluzione dall’equazione di equilibrio delle forze e di quelle di trasferimento di massa e di energia, la metodologia proposta consente di determinare la distanza di sicurezza in differenti condizioni termoigrometriche ovvero in differenti modalità di emissione delle gocce, per esempio nel caso di fonazione.
8. Conclusioni
Controllare la diffusione del virus SARS-CoV-2 in ambienti confinati quali, per esempio, uffici, aule scolastiche o mezzi di trasporto, è fondamentale per garantire lo svolgimento in sicurezza di tutte quelle attività che richiedono interazione e permanenza di più persone in luoghi chiusi.
In mancanza di una terminologia rigorosa e univocamente accettata come quella proposta dallo studio per le modalità di diffusione del virus SARS-CoV-2 e, in particolare, per quelle cosiddette “airborne” e “droplet”, non sarebbe possibile identificare le modalità di trasmissione che determinano la maggior probabilità di contagio, ovvero attuare le contromisure più efficaci alla minimizzazione del rischio.
Sulla base di tale terminologia, lo studio dimostra che ciò che nasce droplet muore droplet, ovvero che la trasmissione per via diretta può avvenire efficacemente solo attraverso goccioline comunque emesse da un soggetto infetto.
Pertanto, l’analisi della modalità di trasmissione del virus SARS-CoV-2 da persona a persona in ambiente confinato può essere limitata a valutare la capacità delle goccioline emesse di raggiungere una determinata distanza in funzione della dimensione (massa), della velocità iniziale con cui sono emesse dal soggetto infetto, e delle condizioni termo-igrometriche (ovvero temperatura e grado di umidità) e fluidodinamiche (correnti convettive, dovute a differenze di temperatura, o forzate, dovute a ventilatori, areazione tramite l’apertura di finestre in presenza di vento) dell’aria nell’ambiente in cui la gocciolina viene emessa.
La definizione stessa di una “distanza di sicurezza”, pertanto, non deve e non può basarsi esclusivamente su considerazioni di tipo aerodinamico (massa, velocità della gocciolina, resistenza in aria, ecc.), ma deve ricomprendere anche una valutazione sull’influenza che può avere il grado di umidità dell’aria ambiente nel favorire o sfavorire la permanenza della gocciolina infetta nell’ambiente.
Come riportato, le goccioline emesse sono caratterizzate da una distribuzione dimensionale che è funzione della modalità con cui vengono emesse, ovvero con atto fonatorio, colpo di tosse, starnuti o semplice respiro. In riferimento al caso di studio riportato, si osserva che:
- Le goccioline emesse di dimensioni maggiori, ovvero nell’ordine dei 100 micron, tendono a cadere al suolo prima di essere evaporate ad una distanza inferiore al metro e In condizioni termoigrometriche favorevoli, ovvero di elevata umidità, tali goccioline potrebbero permanere sulla superficie di arrivo per molto tempo. Al ridursi dell’umidità nell’aria ambiente, viceversa, la goccia, evaporando, tenderebbe a ridurre progressivamente il proprio volume lungo la traiettoria aumentando la propria concentrazione virale sino a scomparire con rilascio dei virioni contenuti. Questi, i virioni,inizierebbero un trasporto cosiddetto “airborne”, ovvero di particelle solide trasportate per via aerea. In tal caso, le bassissime concentrazioni virali e la probabilità dei virioni di depositarsi sulla superficie di contatto in conseguenza al moto casuale browniano che li caratterizza, dà ragione di un rischio di diffusione del contagio trascurabile rispetto al caso droplet.
- Le goccioline più piccole presentano potenzialmente una maggiore capacità di diffusione ad ampio raggio (sino a 2 metri per goccioline di 40 micron nel caso di studio proposto), ma minore carica virale (numero di virioni contenuti a parità di concentrazione dell’emittente). In condizioni termoigrometriche sfavorevoli, potrebbero neutralizzarsi, vaporizzandosi completamente, una volta espulsa dal soggetto infetto, nel giro di qualche secondo. Per diametri più piccoli il tempo necessario può essere calcolato in frazioni di secondo, e comunque molto più rapidamente delle goccioline di dimensione maggiore sopra citate. D’altro canto, se le condizioni termo-igrometriche fossero favorevoli, la gocciolina, in particolare quella di minore dimensione, potrebbe permanere “in sospensione” nell’ambiente, costituendo un pericoloso veicolo di contagio.
- Una goccia che parte con un diametro relativamente grande ed evapora, lungo la traiettoria, potrebbe arrivare al “bersaglio” con la stessa carica virale (qualora essa non venisse dispersa in ambiente), ma con concentrazione assai più elevata proprio in ragione della diminuzione del volume della gocciolina. Tale condizione, come osservato dallo studio, rappresenta quella di maggior rischio in quanto, a parità di tempo morto e velocità di risposta del sistema di difesa umano, all’aumentare della concentrazione virale corrisponderebbe un dilagare dell’infezione maggiore.
Pertanto, sulla base di tali osservazioni, si può affermare che il tempo di persistenza della goccia, ovvero la “distanza di sicurezza”, è funzione del grado igrometrico nell’aria ambiente.
Pertanto, qualora si voglia dare significato al concetto di distanza di sicurezza occorre controllare il grado igrometrico. Infatti, in un ambiente confinato in cui è presente almeno un individuo, le condizioni termoigrometriche dell’aria ambiente non sono costanti nel tempo.
Quindi, ritenersi in sicurezza rispettando la distanza interpersonale in un ambiente confinato implica la necessità di adottare soluzioni tecniche atte a controllare il grado igrometrico. In assenza di ciò, se, per esempio, l’emissione di vapore d’acqua nell’ambiente fosse tale da raggiungere le condizioni di saturazione, a quel punto, il concetto di distanza di sicurezza crollerebbe in conseguenza della persistenza in sospensione delle goccioline di minore dimensione per un tempo teoricamente infinito.
Il controllo del grado igrometrico è dunque l’unico elemento che garantisce il significato e l’efficacia del concetto di “distanza di sicurezza” in contrasto alla diffusione del contagio di SARS-CoV-2. La sola aerazione ciclica dei locali, in assenza di dispositivi per il controllo dell’umidità (deumidificatori), potrebbe comportare, in taluni casi, un peggioramento delle condizioni termoigrometriche nell’ambiente confinato qualora fossimo in presenza, ad esempio, di alta umidità nell’aria esterna, per effetto della pioggia o per la presenza di nebbia o per la diminuzione della temperatura ambiente fino a raggiungere e superare la temperatura del punto di rugiada, ovvero se l’apertura della finestra comportasse una robusta e repentina ventilazione per la presenza di vento che aiuterebbe, senza dubbio, la trasmissione delle gocce nell’ambiente confinato.
Pertanto, sotto certe condizioni termo-igrometriche ambientali, occorre ammettere che l’ambiente interno di un locale ad uso pubblico, correttamente condizionato, è da preferirsi rispetto a quello esterno in riferimento alla diffusione del contagio da SARS-CoV-2.
_____________________
Bibliografia
Benenati & Brosilow. 1962. Void fraction distribution in beds of spheres. AIChE Journal.
Bontempi, E. 2020. First data analysis about possible COVID-19 virus airborne diffusion due to air particulate matter (PM): the case of Lombardy (Italy). Environ. Res. 186, 109639.
Carlos Cordon-Cardo. 2020. SARS-CoV-2 viral load predicts COVID-19 mortality. The Lancet. Vol. 8. https://doi.org/10.1016/S2213-2600(20)30354-4
Chao et al. 2009. Characterization of expiration air jets and droplet size distributions immediately at the mouth opening. Aerosol Science. 40, pp. 122-133
Dbouk & Drikakis, 2020. On coughing and airborne droplet transmission to humans. Phys. Fluids 32, 053310.
Domingo, J.; Marqués, M.; Rovira, J. 2020. Influence of airborne transmission of SARS-CoV-2 on COVID- 19 pandemic. A review. Environ. Res. 188, 109861.
Endo et al. 2020. Estimating the overdispersion in COVID-19 transmission using outbreak sizes outside China. Wellcome Open Res. 5:67. Published 2020 Jul 10. doi:10.12688/wellcomeopenres.15842.3
Ferron & Soderholm. 1990. Estimation of the times for evaporation of pure water droplets and for stabilization of salt solution particles. Journal of Aerosol Science. 21, pp. 415-429.
Hamner et al. 2020. High SARS-CoV-2 Attack Rate Following Exposure at a Choir Practice — Skagit County, Washington, March 2020. Morbidity and Mortality Weekly Report. 69(19), pp. 606–610
Gralton et al. 2020. The role of particle size in aerosolised pathogen transmission: A review. Journal of Infection. 62, pp. 1-13.
Han et al. 2015. Characterizations of particle size distribution of the droplets exhaled by sneeze. Journal of the Royal Society. 10: 20130560.
Lavezzo et al. A. Suppression of a SARS-CoV-2 outbreak in the Italian municipality of Vo’. Nature. 2020 Aug;584(7821):425-429. doi: 10.1038/s41586-020-2488-1. Epub 2020 Jun 30. PMID: 32604404
Lee, K.W., Liu, Y.H. 1980. On the Minimum Efficiency and the Most Penetrating Particle Size for Fibrous Filters. Journal of the Air Pollution Control Association. 30:4, pp. 377-381. DOI 10.1080/00022470.1980.10464592.
Kleiboeker et al. 2020. SARS-CoV-2 viral load assessment in respiratory samples. Journal of Clinical Virology. Vol. 129, 104439.
Kukkonen et al. 1989. The interdependence of evaporation and settling for airborne freely falling droplets. Journal of Aerosol Science. 20, pp. 749-763.
Kupferschmidt. 2020. Why do some COVID-19 patients infect many others, whereas most don’t spread the virus at all? Science. https://www.sciencemag.org/news/2020/05/why-do-some-covid-19-patients-infect- many-others-whereas-most-don-t-spread-virus-all
Jeong et al. 2020. Coronavirus Disease Outbreak in Call Center, South Korea. Emerging Infectious Diseases. 26:8.
Morawska et al. 2009. Size distribution and sites of origin of droplets expelled from the human respiratory tract during expiratory activities. Aerosol Science. 40, pp. 256-269.
Morawska et al. 2011. Modality of human expired aerosol size distributions. Journal of Aerosol Science. 42, pp. 839-851.
Morawska et al. 2020. It Is Time to Address Airborne Transmission of Coronavirus Disease 2019 (COVID- 19). Clinical Infectious Diseases. ciaa939. https://doi.org/10.1093/cid/ciaa939.
OMS. 2020. Modes of transmission of virus causing COVID-19: implications for IPC precaution recommendations. 2020. https://www.who.int/news-room/commentaries/detail/modes-of-transmission-of-virus-causing-covid-19-implications-for-ipc-precaution-recommendations. 2020. Accessed 1st April 2020.
Pujadas et al. 2020. SARS-CoV-2 Viral Load Predicts COVID-19 Mortality. Lancet Respir Med. doi: 10.1016/S2213-2600(20)30354-4.
Rawlinson et al. 2010. The role of particle size in aerosolised pathogen transmission: A review. Journal of Infection. 62, pp. 1-13.
Rothman KJ. 1976. Causes. Am J Epidemiol. 104, pp.587–92.
Sethuraman et al. Interpreting Diagnostic Tests for SARS-CoV-2. JAMA. 2020;323(22):2249–2251. doi:10.1001/jama.2020.8259
Sidebotham et al. 2007. Cardiothoracic Critical Care (1st ed.). Butterworth-Heinemann. Philadelphia, Oxford.
Wells. 1934. On air-borne infection. Study II. Droplets and droplet nuclei. Am. J. Hyg., 20, pp. 611–618.
Yin, J., McCaskill, J.S. 1992. Replication of viruses in a growing plaque: a reaction-diffusion model. Biophys. 61, pp. 1540-1549.
Zhu et al. 2020. A Novel Coronavirus from Patients with Pneumonia in China, 2019. The new England Journal of Medicine.
Xie et al. 2007. How far droplets can move in indoor environments – revisiting the Wells evaporation–falling curve. Indoor Air. 17, pp. 211-215.
Xie et al. 2009. Exhaled droplets due to talking and coughing. J R Soc Interface. Vol. 6: S703–S714.